
Bifenil. bifenil Stabilitatea termică ceva mai mare decât benzen. Acest lucru este de așteptat, deoarece stabilizarea se datoreaza 8 calorii bifenilici energie de rezonanță în plus față de ceea ce se obține în timpul formării a două molecule separate de benzen. Tilicheev [45] a constatat că constanta de viteza a descompunerii bifenil la 500 ° C este de 20 de ori superioară celei a descompunerii naftalină. și că stabilitatea benzenului la bifenil se apropie de stabilitate. Grinsfelder și alții [14] au raportat că descompunerea practic bifenil în contact cu catalizatorul alumino-zirconiu-siliciu la 550 ° C, nu se produce. Meyer și Hoffman [27] a constatat că, la temperatură mai mare se obține 4,4-difenil-bifenil. [C.97]
Dar pentru benzen poate scrie o a doua formulă, complet echivalentă Kekule. în care legăturile simple și duble au schimbat comparativ cu prima formulă. molecula de benzen Real este descris ca un hibrid de rezonanță a două structuri de electroni Kekulé responsabili de formarea de legături duble. delocalizat, unse pe inelul, astfel încât toate legăturile dintre atomii de carbon din benzen sunt egale și intermediare între legăturile simple și duble clasice. Acesta este motivul pentru mai multă stabilitate și caracteristici ale comportamentului chimic al benzen. [C.162]
Hidrogenarea acestor hidrocarburi polifenilen poate fi realizată în două moduri diferite sau un inel hidrogenată, fara a le distruge pe molecula de benzen (acest caz gidryurov) sau Provo di fi suficient de adâncă descompunere hidrogenare, de exemplu, molecula naftalinei în două molecule de benzen (acest lucru are loc în hidrogenare sub presiuni mari în procesul de Bergius). [C.404]
Fig. 53. Locația p-electron-TION norilor în molecula de benzen
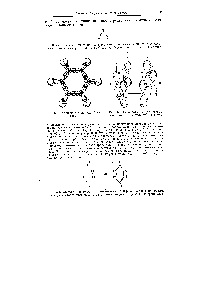
P. 54. I-obligațiuni din molecula de benzen [c.80]
Fig. 131. Schema de obligațiuni într-o moleculă de benzen
Cu toate acestea, formula de benzen. Kekule a propus, nu este potrivit hnmnkov organice. Faptul este că, în multe privințe, molecula de benzen se comporte ca și cum a făcut-o și nu a existat nici o legături duble. (La urma urmei, legăturile duble ar trebui să facă benzen mai activ. Decât ciclohexan, nu mai puțin activ.) În cele din urmă, teoria modernă a structurii materiei permise mai mult sau mai puțin satisfăcător rezolva acest puzzle. Ele sunt prea complexe pentru a intra aici, sunt în valoare de doar SKA, pentru a arăta că se ocupă cu obligațiuni parțiale sau fracționare. Acesta poate fi considerat. că atomii de carbon ai inelului benzenic legat șase sesquioxides identice obligațiuni. care sunt mai puțin activi decât dublu sau chiar simplu. [C.56]
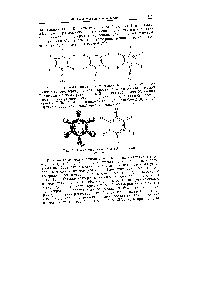
P Ca un alt exemplu al unui sistem cu legături delocalizate consider o molecula de benzen SvNv. Acesta are forma unui hexagon plat, [c.79]
Dezintegrabile L orbitali moleculare libere I și. După cum uanee indicat (vezi. Fig. 54), în molecula de benzen 2p electroni șase atomi de carbon (.brazuyut nelokalizoaannuyu n-obligațiuni. Conform teoriei orbitalilor moleculare această reprezentare corespunde aspectului șase atomice orbitalii 2p -srbitaley șase L-moleculare, trei IȘE care sunt obligatorii, celelalte trei - dezintegrare [c.520]
În moleculele de benzen și alkylaromatics legarea energiei între atomul de carbon în inel și un atom de hidrogen Conoco - tavima cu tăria C. -H -bond în metan și separarea energiei hidrogenului din carbon, conjugat cu un inel aromatic. semnificativ mai mică decât energia C-H -bond în alcani. [C.14]
În schimb, începem cu simetrie rassmotregaya a moleculei de benzen. Am putea lua un alt model al moleculei. cele mai multe dintre care sunt compatibile cu informațiile disponibile cu privire la molecula. obținut anterior. Prin urmare, vom trece direct la modelul care pare cel mai adecvat. In acest model, atomii de carbon sunt situate în colțurile unui hexagon regulat avion, și atomii de hidrogen - în același plan cu privire la lniyah care bisect unghiul de valență atom de carbon. Acest model are un grad ridicat de simetrie cu următoarele elemente ale sasea axa de simetrie, al treilea și al doilea ordin. simetrie plan. ATCM care trece prin și prin legătură C-C, un plan de simetrie. care conține molecula, precum și un centru de simetrie. [C.302]
Esln identifitsirsvany toate frecvență de bază activă de benzen. cele nouă vibrațiile de frecvență inactive sunt încă f Incertitudinile. Această problemă poate fi rezolvată prin intermediul unor calcule matematice adecvate. Să considerăm acum aplicarea acestor considerații la o molecula de benzen. Fig. 3 că fluctuația moleculei de benzen poate fi reprezentat prin utilizarea șase tipuri de interne coordonate deformație valență și deformarea într-un plan asociat cu planul de ieșire al moleculei de legăturile C-C și C-H. Fiecare dintre aceste coordonate este asociată cu o anumită forță constantă. Wilson [12] Următoarea tstsel notații pentru aceste constante de forță [c.304]
Shtokmeyer, aplicat la studiul sistemului. constând din acetat de vinil și benzen, metoda de marcare. Am constatat că, în catena polimerului în moleculele de polimer de benzen 20 a sugerat că acest lucru poate să apară, de asemenea, reacția de copolimerizare (vezi. De mai jos) [141]. De fapt, întreaga problemă a atacului radicalilor asupra sistemului aromatic este în prezent nevyyasneshshm secțiune chimie radicală. [C.126]
Metoda de orbitali moleculari. orbitali moleculari compuși complecși sunt formate pe aceeași nriitsinu și au aceleași proprietăți ca moleculare orbitale intr-o molecula diatomica (vezi. 45). Diferența constă în faptul. în care compușii complecși sunt setul MO-gotsentrovymi, delocalizat, similar cu ceea ce iaprimer are loc în molecula de benzen (vezi. 167). [C.600]
Difenil obținut atunci când piroteneticheokom descompunere Berthelot ning benzen (reprezintă rezultatul condensării dehidrogenarea reacția ooafMvozhdashoy a două molecule de benzen. [C.396]