Sărurile - substanță compusă din molecule care includ anioni (anioni) conectate la cationii de diverse origini (atomii de metal metallovidnuyu grupări, cum ar fi NH + 4. Și așa mai departe ..). Sărurile formate prin reacția de neutralizare a acizilor. sau baze. În general, sărurile sunt substanțe cristaline. Cel mai simplu exemplu săruri - clorură de sodiu. care formula chimică - NaCl.
1. numele
Există mai multe metode de formare a numelor de săruri. Pur și simplu creați sarea din titlu ca acizi, reziduuri acide de denumiri comune internaționale. Astfel, acizii oxigen sare titlu când elementul acid care formează are o valență mai mare care se termină în la. De exemplu:
- KNO 3 - nitrat de potasiu (sulfat de potasiu)
- CaSO 4 - sulfat de calciu (sulfat de calciu)
- Na 3 PO 4 - fosfat de sodiu (fosfat de sodiu)
- BACO 3 - carbonat de bariu (carbonat de bariu)
- Na 2 SiO 3 - silicat de sodiu (silicat de sodiu), etc ...
Denumirile anoxic sărurile acide sunt final sau id id. De exemplu: MgCl2 - clorură de magneziu. KJ - iodură de potasiu, NaBr - bromură de sodiu, Na2S - sulfură de sodiu, etc ...
Dacă o parte metalică a sării prezintă o valență diferită și formează cu același acid reziduuri mai multe săruri, pentru recunoașterea trebuie să indice numărul de resturi acide în moleculă, sărurile sau valența metalului. Când un rest de acid monovalent, atunci în mod tipic indică numărul de resturi acide, prin adăugarea anionului numelui prefix dintre cifrele grecești. De exemplu: CuCl - monoclorură cupru, CuCI2 - diclorura de cupru, etc ...
Când restul de acid al două sau trivalent, apoi indică valența metalului, ceea ce denotă numărul său roman în paranteze după numele metal. De exemplu: Cu 2 SO 4 - sulfat de cupru (I), CUSO4 - sulfat de cupru (II), Fe 2 (SO 4) 3 - sulfat de fier (III), etc ...
În numele săruri acide adăugate prefix sau hidro-dihidro-. De exemplu: NaHSC 4 - sulfat de sodiu, NaH2PC 4 - fosfat diacid de sodiu, CaHPO 4 - fosfat de calciu, Ca (H 2 PO 4) 2 - dihidrogen fosfat de calciu, etc ..
Denumirile de săruri bazice formate de la un nume de reziduuri acide și cuvinte hidroxid sau Dihidroxid. De exemplu: AlOHSO 4 - hidroxid sulfat aluminiu, Al (OH) 2 CH3 COO - acetat de dihydroxide aluminiu, Cu2 (OH) 2 CO 3 - carbonat-dihydroxide de cupru (II), etc ...
2. Metode de obținere a
1. Prin substituirea atomilor de hidrogen din moleculele de acizi atomi metalici:
2. La schimbarea grupelor hidroxil în molecule tulpini în molecule de acid resturilor acide. Esența acestei reacții este schimbul de atomi de hidrogen din moleculele de acid molecule atomii de metal de bază (cu aceeași probabilitate pentru schimbul grupărilor hidroxil pe bazele moleculare ale resturilor acide molecule acide), formând astfel o (reacție de neutralizare), sare și apă:
3. În reacția acizilor cu oxizi de bază:
4. Atunci când reacția acidului cu oxizi amfoteri:
5. În reacția acizilor cu săruri:
6. În reacția acizilor cu un metal:
7. În reacția bazelor cu oxizi acizi:
8. În reacția de baze cu săruri:
9. În reacția acidului cu oxizi de bază:
10. În reacția sărurilor:
11. În combinație cu săruri metalice:
12. Prin reacția metalelor cu nemetale:
Există și alte metode de obținere a sărurilor.
Nu fiecare dintre aceste metode, puteți obține orice sare. Sărurile acide de adiție sunt de obicei formate prin reacția sării normale cu același acid. De exemplu:
Sărurile bazice sunt formate mai frecvent atunci când forma de sare cu cantități relativ mici de alcaline. De exemplu:
3. Clasificarea
Există mai multe modalități de clasificare săruri:
- Prin acidul care corespunde sării (. Fosfații clorură. Nitrații)
- Prin săruri medii și mijlocii (normale), săruri acide, săruri bazice
3.1. Adică sare (normal)
Dacă toate hidrogenii acide din acizii molecule sunt schimbate sau înlocuite cu atomi metalici sau toate grupările hidroxil din molecula pe baza unui anioni de schimb de molecule de acid, astfel de săruri se spune că sunt normale, sau mediu, sau pur și simplu săruri. De exemplu,
Bazat pe teoria disocierii electrolitice. săruri numite substanțe complexe, care în soluție apoasă este disociat în cationi metalici și anioni de reziduuri acide. Normal nu există alte cationi și anioni de sare nu formează alte:
- KCl (aq) K + (aq) + Cl - (Aq)
- Al 2 (SO 4) 3 (aq) 2 Al 3 + (aq) + 3 SO 2 - 4 (Aq)
3.2. Sărurile acide
Dacă numai o parte din atomii de hidrogen acizi ai moleculelor de acid schimbate sau înlocuite cu atomi de metal, astfel de săruri sunt denumite acide sau gidrosolyamy. De exemplu:
Sărurile acide disociază în soluție apoasă cu cationi metalici, anioni și cationi resturile de hidrogen de acid. Astfel, în cazul în care sarea acidă este atât o sare, deoarece aceasta formează o cationi metalici și de disociere acidă, deoarece ambele forme și cationi de hidrogen:
- NaHSC 4 (aq) Na + (aq) + H + (aq) + SO 2 - 4 (Aq)
- CaHPO 4 (aq) Ca 2 + (aq) + H + (aq) + PO 3 - 4 (Aq)
Ionii de hidrogen ai sării acidului prin reacția acestuia cu o bază, de asemenea, pot fi schimbate pentru ionii metalici de la formarea sărurilor normale și apă:
3.3. săruri bazice
În cazul în care numai o parte a grupărilor hidroxil din moleculele pe baza unui anioni de schimb de molecule de acid, astfel de săruri sunt numite de bază:
Sărurile bazice în soluții apoase disociază în cationi și anioni metalici și anionilor hidroxil. Astfel, sarea de bază în cazul în care sarea este atât pentru că formează anioni după disocierea resturilor acide și a substratului, și, prin urmare, care formează anioni hidroxid:
- Cu (OH) Cl Cu 2 + (aq) + OH - (aq) + Cl - (Aq)
- Fe (OH) 3 CO 3 Fe + (aq) + OH - (aq) + CO2 - 3 (aq)
Ambele aceste săruri în apă, practic insolubil, dar o parte solubilă a acestuia se descompune la ecuațiile de mai sus. Hidroxil ioni de sare bazică prin reacția cu un acid poate fi de asemenea schimbate pentru anioni pentru a forma săruri normale
4. Formula structurală
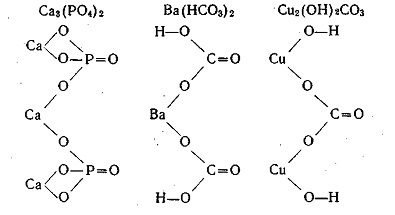
din formulele acizi sau baze adecvate prin înlocuirea acide atomii de hidrogen ai atomilor metalici sau grupele hidroxil pe baza de reziduuri acide în formulele structurale ale imaginii sărurilor. De exemplu, vom da formulele structurale ale fosfat de calciu, carbonat de bariu și carbonat de cupru bazic:
5. proprietăţi
Toate sărurile sunt solide cristaline. Referitor la căldură niște sare suficient de stabile. De exemplu: NaCI, KCI, Na2 SO4, etc. Aceste săruri pot fi încălzite la temperaturi de topire și chiar de fierbere, și nu se descompune. săruri Altele sunt instabile și se descompun la căldură fără a se topi. De exemplu:
Conform sărurilor solubile în apă sunt împărțite în ușor solubile, slab solubil și practic insolubil. Acestea sunt toate săruri bine solubile ale acidului azotic și acetat, precum și aproape toate de sodiu, potasiu și amoniu. Prin substanțial săruri insolubile sunt clorură de argint AgCl, sulfat de bariu BaSO 4, toți silicați (cu excepția NaSiO 3 și K 2 SiO 3), și altele.
Proprietățile chimice determinate prin sărurile lor de acizi. fundații. și alte săruri metalice.
1. Sărurile cu acizi pot interacționa numai atunci când acidul reacționează mai puternic decât cel din care se produce sarea. De exemplu:
2. Sărurile pot interacționa cu pajiști. se formează atunci când o bază insolubilă sau o sare insolubilă în reacție. De exemplu:
3. Soluțiile sărurilor pot interacționa cu metalul atunci când metalul din stresul serie electrochimic este lăsat sare de metal. De exemplu:
4. Multe săruri în soluție pot interacționa unul cu celălalt atunci când una dintre sărurile formate în reacție este insolubilă. De exemplu:
Acest text poate conține erori.