la rata de Chimie Organică
Poziția teoretică pe tema „Aromatics“. Definiția hidrocarburilor aromatice, precum și conceptul de „aromaticitate“. Acesta descrie structura moleculei de benzen. Nomenclatură considerate izomerie și compuși aromatici cu nucleu de benzen. Metodele de bază pentru obținerea arenelor discută, de asemenea, proprietățile fizice și chimice ale hidrocarburilor aromatice.
Este proiectat pentru studenții din zonele I și II cursuri de zi și forme de corespondență de specialități de formare PSM ZCHS, MTP, BTP și UA.
Compilatoare: candidat. Chem. Stiinte, Assoc.
Cand. Chem. Stiinte, Assist.
Referent: candidat. Chem. Stiinte, Assoc.
Compuși aromatici (arenelor) - compus organic cu o structură plană ciclică, în care toți atomii de carbon formează un sistem π electron unic, delocalizat, conținând conductoare (4n + 2) tt-electroni.
Compuși aromatici sunt în primul rând C6 H6 benzen și numeroasele sale derivate și omologi. Compușii aromatici pot conține în moleculă una sau mai multe nuclee de benzen (aromatice polinucleare). Dar ne vom uita compuși aromatici cu un inel benzen.
Structura moleculei de benzen
Benzenul descoperit de Michael Faraday in 1825 in iluminare (kok-sovom) de gaz, iar structura moleculei de benzen este cel mai adesea exprimată prin formula, pre-Proposition chimist german Kekulé (1865)
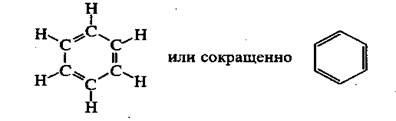
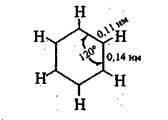
Conform ideilor moderne molecula de benzen are o structură plană a unui hexagon ale cărui laturi sunt egale și este de 0,14 nm. Această distanță este valorile medii între 0.154 nm (lungimea legăturii unică) valori-niem și 0.134 nm (lungimea unei duble legături). Nu numai atomi de carbon, dar și cele asociate șase atomi de hidrogen sunt coplanare. Unghiuri, obligațiuni imagine-H en-C și C-C, egal cu 120 °:
Toți atomii de carbon din molecula de benzen sunt în sp2 hibridizare. Fiecare dintre ele este asociat cu trei orbitali hibrizi ai săi aceiași doi orbitali de doi atomi de carbon adiacenți și un orbital al atomului H pentru a forma trei # 963; -bond (a se vedea figura.). În al patrulea rând, nehibridizate 2p orbitală a atomului de carbon, care este axa perpendiculară pe planul inelului benzenic, se suprapune cu co-orbitali similare din doi atomi de carbon vecine din dreapta și la stânga.

sistem de învățământ # 963; -bonds și tt-obligațiuni în molecula de benzen
O astfel de suprapunere apare deasupra și sub planul inelului benzenic. În rezultatele, cele formate printr-un singur sistem închis de tt-electroni. Ca urmare a unei astfel de re-uniform kryvaniya 2p orbitali tuturor celor șase atomi de carbon-TION este „aliniere“ de legături simple și duble, adică pe inelul benzenic sunt legături duble și single clasice. distribuție uniformă densitate π-electroni între toți atomii de carbon datorita delocalizare π-electron și este cauza moleculei de benzen de înaltă rezistență. În prezent, nu există nici o modalitate unică de imagini grafice ale moleculei de benzen cu proprietățile sale reale. Dar, pentru a sublinia uniformitatea densității π-electroni în molecula de benzen, recurg la următoarele formule:
Ar trebui, cu toate acestea, amintiți-vă că nici unul dintre aceste formule nu răspunde la starea fizică reală a moleculei, și în plus pot să nu reflecte diversitatea proprietăților sale. formula Kekule yaschee în prezent timpul este pur și simplu o moleculă simbol benzen. Cu toate acestea, ei Roko Shih folosit, având în vedere limitările sale.