Cel mai simplu model al teoriei moleculare-cinetice, este un model al unui gaz ideal. Modelul cinetic al moleculelor ideale de gaz sunt tratate ca mingi perfect elastice și care interacționează cu pereții numai în timpul ciocnirilor elastice. Volumul total al tuturor moleculelor este presupus mic în comparație cu volumul vasului în care gazul. Modelul de gaz ideal descrie destul de bine comportamentul gazelor reale pe o gamă largă de presiuni și temperaturi. Ținta Teoria cinetică moleculară este de a stabili o legătură între microscopice (greutate, viteza, energia cinetică a moleculelor) și parametrii macroscopice (presiune, volum, temperatură).
Ca rezultat, fiecare coliziune între moleculele și moleculele cu pereții vitezei moleculelor pot varia în mărime și în direcție; la intervale de timp între ciocnirile succesive de molecule care se deplasează în mod uniform și rectiliniu. Modelul gazului ideal presupune că toate coliziunile au loc în conformitate cu legile de coliziune elastice, t. E. Sub rezerva legilor mecanicii newtoniene.
Folosind modelul unui gaz ideal, se calculează presiunea gazului pe peretele vasului. În timpul interacțiunea moleculei cu peretele vasului între acestea, forțele apar legea a treia a lui Newton supunerea. Ca rezultat, proiecția vitezei moleculei υx, perpendicular pe perete, schimba semnul la opusul, iar proiecția υy viteză paralelă cu peretele, rămâne neschimbat (Fig. 3.2.1).
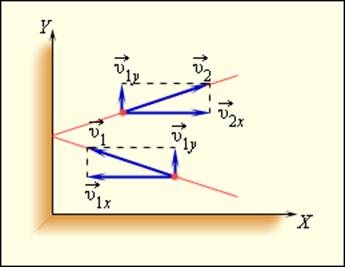
coliziune elastică cu peretele moleculei
Prin urmare, modificarea în impuls a moleculei este egală cu 2m0 υx. unde m0 - masa moleculei.
Isolate pe un perete al unei anumite zone S (fig. 3.2.2). În timpul acestei zone va AT confrunta cu toate moleculele care au o viteză de proiecție υx. îndreptate spre perete și să rămână în cilindru la S bază și zona de înălțime υx AT.
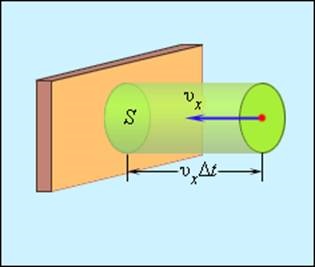
Determinarea numărului de coliziuni între molecule cu site-S
Lăsați pe unitatea de volum al vasului conține n molecule; apoi numărul de molecule din volumul cilindrului este egal cu nS υx DT. Dar acest număr este doar mișcă jumătate față de perete și celelalte se deplasează jumătate în direcția opusă și cu peretele nu se confruntă. Prin urmare, numărul de coliziuni ale moleculelor din zona S este egală cu un timp AT
Deoarece fiecare moleculă după coliziune cu peretele schimbă impulsul său de cantitatea de 2m0 υx. variația totală a impulsului tuturor moleculelor în timpul ciocnindu platformei egală cu S. AT
Conform legilor mecanicii este o schimbare a ritmului de coliziune cu peretele moleculelor are loc sub influența impulsului de putere F AT. în cazul în care F - o anumită forță medie care acționează pe peretele lateral al moleculei la locul de S. Dar legea a 3-a lui Newton este aceeași în acte de forță absolute din partea moleculelor în sol S. Prin urmare, putem scrie:
Impartind ambele părți de S AT. obținem:
unde p - presiunea gazului pe peretele vasului.
În derivarea acestei relații se presupune că toate moleculele n conținute într-o unitate de volum de gaz, proiecțiile au aceeași viteză pe axa X. In realitate nu este.
Ca rezultat, mai multe ciocniri între gazul se moleculele și cu pereții unui vas care conține un număr mare de molecule, este stabilită o distribuție statistică a vitezei. În acest caz, toți vectorii de direcție ale vitezelor moleculare sunt egale (egal probabile) și modulele de viteze și proiecțiile lor pe axele de coordonate sunt supuse anumitor legi. Distribuția moleculelor de gaz se numește distribuție viteză modulo Maxwell. Dzheyms Maksvell în 1860, a adus legea de distribuție a moleculelor de gaz peste viteze, pe baza prevederilor de bază ale teoriei moleculare-cinetice. Fig. 3.2.3 Curbele sunt reprezentative pentru distribuția vitezei. Abscisa este modulul de viteză, iar ordonata - numărul relativ de molecule ale căror viteze sunt în intervalul de până υ υ + δυ. Acest număr este egal cu zona evidențiată în fig. 3.2.3 coloană.
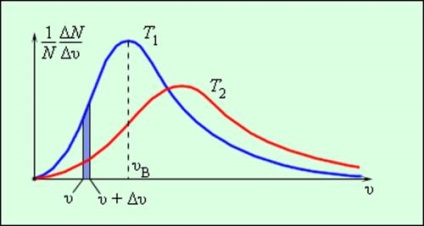
Distribuția vitezelor moleculare. T2> T1
distribuție Maxwell parametri caracteristici sunt cel mai probabil υv de viteză. corespunde maximului vitezei curbei de distribuție și rms
- medie viteza pătrat.
Cu creșterea temperaturii, maximul curbei de distribuție este deplasată la viteze mai mari, în timp ce υv și υkv creștere.
Pentru a clarifica formula pentru presiunea gazului în peretele vasului, să presupunem că toate moleculele conținute într-o unitate de volum, împărțite în grupe, conținând n1. n2. g n3 și m.. molecule cu viteze proiecții υx1. υx2. υx3 și t. d., respectiv. În acest caz,
Fiecare grup de molecule contribuie
presiunii gazului. Ca urmare a coliziunii cu peretele de molecule cu diferite valori ale presiunii totale a proeminențelor are loc vitezei υxi
În această sumă expresie - suma pătratelor proeminențelor υx toate moleculele n per unitatea de volum de gaz. Dacă această sumă este împărțită la n. obținem pătrat medie a proiecției vitezei moleculelor:
Această ecuație stabilește relația dintre presiunea p gaz ideal, m0 masa a moleculei. concentrația de n molecule. valoarea medie a vitezei la pătrat și energia cinetică medie a mișcării de translație a moleculelor. Aceasta se numește ecuația fundamentală a teoriei cinetice moleculare a gazelor.
Astfel, presiunea gazului este egală cu două treimi din energia cinetică medie a mișcării de translație a moleculelor conținute în unitatea de volum.
Ecuația fundamentală a teoriei cinetice moleculare a gazelor conține o concentrație de produs de n molecule din energia cinetică medie a mișcării de translație. Presupunând că gazul stocat în constanta vasul V. volumul
(N - numărul de molecule din vas). În acest caz, schimbarea de presiune este AP proporțională cu variația energiei cinetice medii.
Întrebările apar: cum să schimbe experiența energiei cinetică medie a mișcării de molecule într-un vas de volum constant? Ce cantitate fizică care urmează să fie modificat pentru a schimba cinetică medie de energie Experiența arată că această cantitate este temperatura.
Conceptul de temperatură este strâns legată de conceptul de echilibru termic. Corpurile sunt în contact unele cu altele, pot partaja energie. Energia transferat într-un alt corp cu contact termic, numita cantitate de căldură.
echilibru termic - este un sistem de stat de organisme care sunt în contact termic, în care nu există nici un transfer de căldură de la un corp la altul, și toți parametrii macroscopice ale organismelor rămân neschimbate. Temperatura - este un parametru fizic, care este aceeași pentru toate corpurile sunt în echilibru termic. Posibilitatea introducerii conceptului de temperatură trebuie să fie din experiență, și se numește legea zero a termodinamicii.
Pentru a măsura temperatura folosind instrumente fizice - termometre. în care o valoare a temperaturii este evaluată prin schimbarea unei proprietăți fizice. Pentru a crea un termometru trebuie să selecteze substanța termometrică (de exemplu, mercur, alcool) și valoarea thermometric. caracterizând proprietatea unei substanțe (de exemplu, lungimea coloanei de mercur sau alcool). In diverse constructii termometre folosesc o varietate de proprietăți fizice ale substanței (de exemplu, modificări ale dimensiunilor liniare ale solidelor sau schimbare în rezistența electrică a conductorilor prin încălzire).
Termometre ar trebui să fie calibrate. În acest scop, ele sunt aduse în contact termic cu organismele care respectiva temperatură predeterminată. Cele mai frecvent utilizate sisteme naturale simple, în care temperatura rămâne constantă, în ciuda schimbului de căldură cu mediul - un amestec de gheață și apă și amestec de apă și abur prin fierbere la presiune atmosferică. Prin Celsius scala temperatura gheții topire este atribuită temperatura de 0 ° C și punctul de fierbere al apei - 100 ° C. Modificarea lungimii coloanei de lichid din termometru capilar o sutime din lungimea între marcajele 0 ° C și C este luat egal cu 100 ° până la 1 ° C În unele țări (SUA) este utilizat pe scară largă Fahrenheit (TF), în care temperatura de congelare a apei este luată egală cu 32 ° F, iar punctul de fierbere al apei egal cu 212 ° F. Prin urmare,
Locul special in fizica ocupa termometru cu gaz (Figura 3.2.4.), În care substanța termometrică este gazul rarefiată (heliu, aer) într-un vas de volum constant (V = const), o cantitate termometrică - presiunea gazului p. Experiența arată că presiunea gazului (la V = const) crește odată cu creșterea temperaturii, măsurate pe scara Celsius.
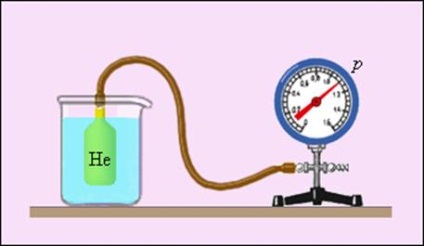
fizicianul englez William Kelvin (Thomson) în 1848 a propus utilizarea unui punct de presiune a gazului zero pentru construirea unei noi scale de temperatură (scara Kelvin). La această scară, unitatea de măsurare a temperaturii este aceeași ca și în scara Celsius, dar punctul zero este deplasată:
Unitatea SI de măsură acceptate Kelvin Kelvin apel temperatură notată cu litera K. De exemplu, temperatura camerei TA = 20 ° C Kelvin este egal cu TC = 293,15 K.
scala de temperatură Kelvin se numește scara absolută a temperaturii. Acesta este cel mai convenabil pentru construirea de teorii fizice.
Nu este nevoie de a lega scara Kelvin la două puncte fixe - punctul de topire a gheții și punctul de fierbere a apei la presiunea atmosferică, așa cum se obișnuiește în scara Celsius.
De asemenea, presiunea gazului de punctului zero, care se numește absolut temperatura zero. suficient pentru a lua un alt punct de referință fix. Scara Kelvin ca atare este utilizat în ceea ce privește temperatura apei a punctului triplu (0,01 ° C), în care toate cele trei faze sunt în echilibru termic - gheață, apă și abur. Temperatura Kelvin a punctului triplu se presupune a fi 273,16 K.
termometre de gaz sunt greoaie și incomod pentru utilizarea practică: acestea sunt folosite ca standard pentru calibrare de precizie a altor termometre.
Astfel, presiunea gazului rarefiate într-un vas de volum constant V este direct proporțională cu temperatura absolută: p
T. Pe de altă parte, experiența arată că la volum constant V și presiunea gazului T temperatura variază direct proporțional cu cantitatea de substanță raportul ν în vasul la volumul V al vasului
unde N - numărul de molecule din vas, NA - numărul Avogadro, n = N / V - concentrația moleculară (de exemplu, numărul de molecule pe unitatea de volum al vasului ..). Combinând aceste relații de proporționalitate, putem scrie:
unde k - o constantă universală pentru toate gazele. Aceasta se numește constanta Boltzmann. în onoarea fizicianului austriac Lyudviga Boltsmana, unul dintre fondatorii teoriei moleculare-cinetice. constanta lui Boltzmann - una dintre constantele fizice fundamentale. Valoarea sa numerică în SI este:
k = 1,38 · 10 -23 J / K.
Comparând raportul p = nkT cu ecuația de bază teoria cinetică moleculară a gazelor, se pot prepara următorii compuși:
Medie Mișcarea energiyahaoticheskogo cinetică a moleculelor de gaz este direct proporțională cu temperatura absolută.
Astfel, temperatura este o măsură a energiei cinetică medie a mișcării de translație a moleculelor.
Trebuie remarcat faptul că energia cinetică medie a mișcării de translație a unei molecule este independentă de masa sa. particulă browniană în suspensie în lichid sau gaz are aceeași energie cinetică medie ca moleculă separată a cărei masă este de mai multe ordine de mărime mai mică decât masa particulelor browniene. Această concluzie se aplică în cazul în care nava este chimic amestec neinteracțiune de gaze, din care moleculele au mase diferite. In starea de echilibru ale moleculelor gaze diferite vor avea o energie cinetică medie identică mișcării termice determinate numai de temperatura amestecului. amestec de gaz sub presiune în peretele vasului va consta din presiunile parțiale ale fiecărui gaz:
Acest raport n1. n2. n3. ... - concentrația moleculară a diferitelor gaze în amestec. Această relație este exprimată în limbajul teoriei moleculare cinetice stabilit experimental la începutul secolului XIX, legea lui Dalton: presiunea din amestecul de vedere chimic care nu interacționează cu gaz egală cu suma presiunilor parțiale.