Definiție și formula ecuația MKT
Ecuația care stau la baza teoriei cinetice moleculare se leagă cantități macroscopice care descriu starea unui gaz ideal (de exemplu, presiune), cu parametrii moleculare (masele și vitezele lor). Această ecuație este de forma:
Aici - masa moleculelor de gaz, - concentrația de astfel de particule pe unitatea de volum, - medie a vitezei la pătrat a moleculelor.
De bază MKT ecuație explică în mod clar modul în care ideală de gaz creează o presiune pe peretele vasului din jur. Moleculele din toate timpurile lovit de perete în timp ce lucrează la ea cu o forță F. Aici ar trebui să ne amintim a treia lege a lui Newton. când molecula lovește obiectul, acesta este supus -F forță, rezultând într-o moleculă „respingeri“ de perete. În acest caz, considerăm coliziunea de molecule cu peretele complet elastic: energia mecanică a moleculelor și peretele este complet conservat, fără a intra în energia internă a corpurilor. Acest lucru înseamnă că, în timpul ciocnirilor variază doar viteza moleculelor, și molecule și încălzirea peretelui nu are loc.
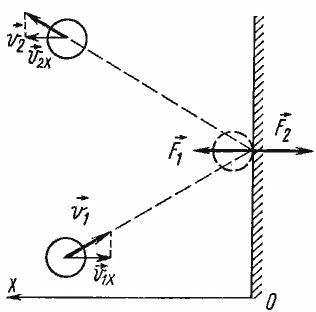
Știind că coliziune cu peretele a fost elastic, putem prezice modul in care moleculele schimba viteza după ciocnire. Unitatea de viteză va rămâne aceeași ca și înainte de coliziune, iar direcția de deplasare este inversată în raport cu axa x (cred Oh - aceasta este axa care este perpendiculară pe perete).
Moleculele de gaz sunt atât de multe, ele se deplasează haotic pe perete și a lovit de multe ori. Găsiți locul geometric al cantității de forță cu care fiecare moleculă acționează pe perete, vom găsi puterea presiunii gazului. La viteza medie a moleculelor, trebuie utilizate metode statistice. Acesta este motivul pentru care MKT ecuația de bază folosește viteza medie pătrată a moleculelor, în loc de viteza medie pătrat: viteza medie de molecule care se deplasează în mod aleatoriu este zero, iar noi nu ar fi primit, în acest caz, nici o presiune.
Acum, sensul fizic al ecuației: mai mult moleculele conținute în volum decât sunt mai grele și mai rapid decât în mișcare - mai mult presiunea la care creează pe pereții vasului.
MKT ecuația de bază pentru modelul ideal de gaz
Se observă că ecuația de bază pentru modelul dedus LCI gaz ideal cu ipoteze relevante:
- Coliziuni ale moleculelor cu obiectele din jur absolut elastic. Pentru gazele reale același lucru nu este destul de adevărat; o parte din energia cinetică a moleculelor încă trece în energia internă a moleculelor și perete.
- interacțiunea Forța dintre moleculele pot fi neglijate. Dacă gazul este efectiv la presiune ridicată și temperatură relativ scăzută, aceste forțe devin substanțiale.
- Molecule sunt puncte materiale, fără a ține seama de mărimea lor. Cu toate acestea, dimensiunile reale ale moleculelor de gaz afectează de distanța dintre moleculele și perete.
- În sfârșit, MKT ecuația de bază consideră uniformă a gazului - dar, în realitate, de multe ori avem de a face cu amestecul de gaz. Ca un exemplu, aerul.
Cu toate acestea, pentru gaze rarefiate această ecuație dă rezultate foarte precise. În plus, multe gaze cu reale la temperatura camerei și la o presiune aproape atmosferică, foarte asemănătoare cu proprietățile gazelor perfecte.
După cum se cunoaște din legile dinamicii. energia cinetică a unui corp sau o particulă. Înlocuirea produsul masei fiecăruia dintre particule și pătratul vitezei înregistrată în ecuația noastră, putem prezenta sub formă de:
De asemenea, energia cinetică a moleculelor de gaz este exprimată prin formula, care este adesea folosit în aplicații. Aici k - constanta lui Boltzmann, care stabilește legătura între temperatură și energie. k = 1,38 • 10 -23 J / K.
MKT de bază ecuația stă la baza termodinamicii. De asemenea, este utilizat în practică în industria aerospațială, criogenie și neutroni fizica.