procesele care au loc în sistemele statistice de învățare, o dimensiune minimă a particulelor este complicată și un număr mare de ele. Luați în considerare separat fiecare particulă este practic imposibilă, totuși introduc cantități statistice: viteza medie a particulelor, concentrația lor, masa particulelor. Formula care caracterizează starea sistemului cu parametrii microscopici, numită ecuația fundamentală a teoriei cinetice moleculare a gazelor (ICB).
Un pic despre viteza medie a particulelor
Determinarea vitezei particulelor a fost realizată pentru prima dată în mod experimental. Cunoscut din experimentul curriculum realizat Otto Shternom, a permis de a crea o imagine a vitezelor particulelor. Experimentul a investigat mișcarea atomilor de argint în cilindri rotitori: prima instalare staționară, atunci când se rotește cu o anumită viteză unghiulară.
Ca rezultat, sa constatat că rata de molecule de argint depășește viteza sunetului și este de 500 m / s. Faptul este destul de interesant, deoarece o astfel de viteza particulelor substanțelor ca o persoană să se simtă greu.
perfectă de gaz
Pentru a continua să studieze fezabil numai în sistem, parametrii care definesc măsurătorile directe pot fi bazate pe dispozitive fizice. Viteza este măsurată vitezometru, dar ideea este de a atașa un vitezometru la o singură particulă este absurdă. măsura în mod direct numai parametru macroscopic legat de mișcarea particulelor.
Orice sistem de corpuri care interacționează se caracterizează prin energia potențială și energia cinetică a mișcării. Real de gaz - un sistem complex. Variabilitatea energiei potențiale sfidează sistematizare. Problema poate fi rezolvată prin introducerea unui model, proprietățile caracteristice ale gazului purtător spulberă complexitatea interacțiunii.
Un gaz ideal - o stare a materiei în care interacțiunea dintre particule este neglijabilă, energia potențială a interacțiunii tinde la zero. Ea poate fi luată în considerare numai energia cinetică semnificativă, care depinde de viteza particulelor.
Presiune gaz ideal
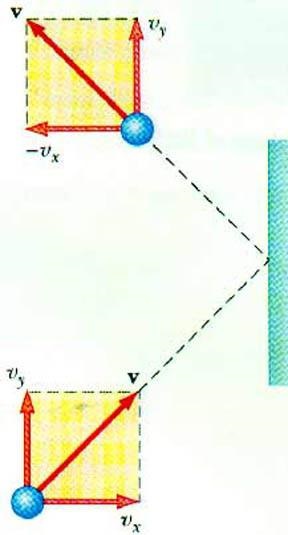
Identifica relația dintre presiunea gazului și viteza particulelor permite ecuația MKT gazului de bază ideală. O particulă se deplasează într-un vas, în coliziune cu peretele acesta transmite un impuls a cărui valoare poate fi determinată pe baza a II-legea lui Newton:
Schimbarea impulsului particulelor în stare de șoc elastic asociat cu schimbarea componentei orizontale a vitezei sale. F - forța exercitată de către particulele pe perete pentru un timp scurt t; m0 - masa particulei.
Pe suprafața S în timpul timpului zona cu care se confruntă toate particulele At gaz care se deplasează în direcția de suprafață la o viteză vx și dispuse în volumul cilindrului Sυx AT. Atunci când concentrația particulelor n exact molecule jumătate se mută la perete, a doua jumătate - în direcția opusă.
Luând în considerare coliziunea particulelor, putem scrie legea lui Newton pentru forța care acționează pe platforma:
Deoarece presiunea gazului este definită ca raportul dintre forța care acționează perpendicular pe suprafața, ultima zonă poate fi scris:
Această ecuație relație ca LIC de bază poate descrie întregul sistem, adică. K. Mișcarea numai într-o singură direcție.
distribuție Maxwell
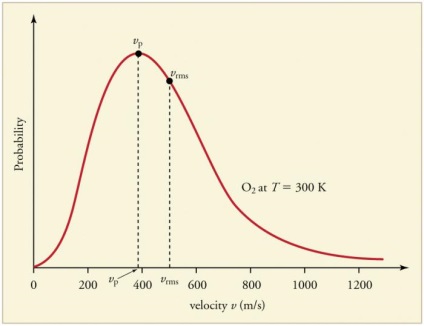
ciocniri frecvente persistente ale particulelor de gaz cu pereții și reciproc duc la stabilirea unui anumit distribuție statistică a vitezei particulelor (energie). Direcția de vectorilor viteză sunt la fel de probabile. O astfel de distribuție a fost numit distribuția Maxwell. In 1860, acest model a fost derivat J. Maxwell sub ICB. Principalii parametri ai legii de distribuție se numește viteza: probabil corespunde valorii maxime a curbei și VKV medie pătrat = √‹v 2 › - viteza medie pătrată a particulelor.
Creșterea temperaturii gazului corespunde unei creșteri a valorilor vitezei.
Bazat pe faptul că toate vitezele sunt egale, iar modulele lor au același sens, pot fi luate în considerare:
- ‹v 2 › = ‹vx 2 › + ‹vy 2 › + ‹VZ 2 ›În cazul în care: ‹vx 2 › = ‹v 2 ›. 3
MKT ecuația de bază cu valorile medii ale presiunii gazului ia forma:
Această relație este unică prin faptul că definește relația dintre parametrii microscopici: viteza, masa presiunii particulelor, densitatea particulelor și a gazului ca întreg.
Folosind conceptul de energie cinetică a particulelor, The MKT ecuația de bază poate fi rescrisă:
Presiunea gazului este proporțională cu valoarea medie a energiei cinetice a particulelor sale.
temperatură
Interesant, pentru cantitatea constantă a gazului în vas închis poate fi conectat presiunea gazului și energia medie a mișcării particulelor. în care măsurarea presiunii poate fi realizată prin măsurarea energiei particulelor.
Cum de a intra? Ce poate fi comparat cu cantitatea de energie cinetică? Această cantitate este temperatura.
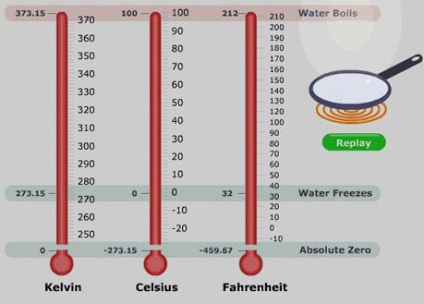

Gama de temperatură universală
Mai interesant în ceea ce privește independența proprietăților de lucru ale corpului poate fi privit ca un termometru cu gaz. Gama lor nu depinde de tipul de gaz utilizat. Într-un astfel de dispozitiv poate distinge temperatura la care ipotetic gazul tinde la presiune zero. Calculele arată că această valoare corespunde -273.15 ° C Intervalul de temperatură (scală de temperatură absolută sau scara Kelvin) a fost introdusă în 1848 an. Pentru punctul principal al acestei scale a luat temperatura posibila presiune a gazului de grad zero. interval unitate scală egală cu valoarea unitară Celsius. Ecuația de bază Înregistrarea folosind temperaturi ILC este mai convenabil în studierea proceselor de gaz.
Presiune de comunicare și temperatură
Empiric se poate asigura presiunea gazului este proporțională cu temperatura. În același timp, a constatat că presiunea este direct proporțională cu concentrația particulelor:
unde T - temperatura absolută, k constantă egală cu 1,38 • 10 -23 J / K.
Valoarea fundamentală având o valoare constantă pentru toate gazele, numită constanta Boltzmann.
Comparând dependența de presiune și de temperatură a gazelor de bază ecuația MKT se poate scrie:
Valoarea medie a energiei cinetice a mișcării moleculelor de gaz este proporțională cu temperatura. Adică, temperatura este o măsură a energiei cinetice a mișcării particulelor.
