Amestecul diferă unul de altul în aparență.
Clasificarea amestecurilor prezentate mai jos:
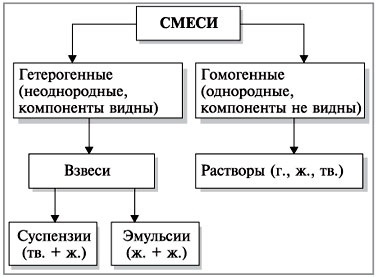
Dați exemple de suspensii (râu nisip + apa), emulsii (ulei + apă) și soluții (aer în flacon, sare + apă, mici din aluminiu sau cupru monede + nichel + cupru).
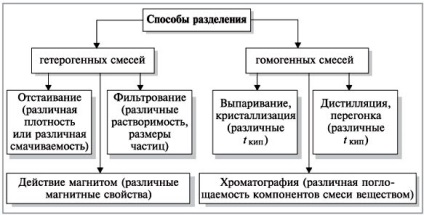
Metodele de separare a amestecurilor
În natură, există substanțe sub formă de amestecuri. Pentru cercetarea de laborator, producția industrială pentru nevoile de farmacologie si medicina au nevoie de substanțe pure.
Diferite metode de separare a amestecurilor de substanțe folosite pentru curățare
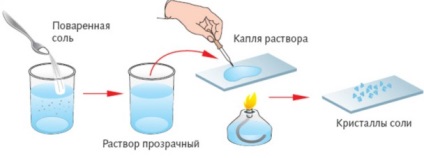
selecție Vyparivanie- dizolvat într-un mod solid lichid transformarea ei în abur.
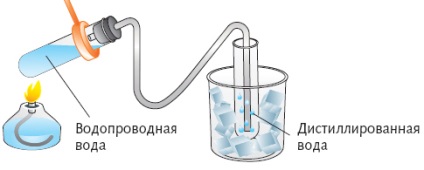
Separarea Distilarea-distilare conținute în amestecuri lichide de substanțe la temperaturi urmate de abur de răcire fierbere.
În apă natură în formă pură (fără sare) nu se produce. Ocean, mare, râu, bine și apă de izvor - o varietate de soluții de sare în apă. Cu toate acestea, de multe ori oamenii au nevoie de apă curată care nu conține sare (utilizate în motoarele auto, în producția de produse chimice pentru diferite fluide și substanțe în fabricarea de imagini). Această apă se numește distilată și metoda acesteia - distilare.
Lichide Filtrovanie- percolare (gaz) printr-un filtru în vederea curățirii lor din solide.
Aceste metode se bazează pe diferențele în proprietățile fizice ale componentelor amestecului.
Luați în considerare metodele de separare a amestecurilor geterogennyhi omogene.
Cantitatea de fier, de asemenea, 0,25 mol. Puteți găsi o mulțime de ea:
MFE = 0,25 • 56 = '14
Acum este posibil să se calculeze fracțiunea de masă a metalelor în amestec:
ωFe = MFE / mvsey amestec = 14/20 = 0,7 = 70%
Răspuns: 70% fier, 30% cupru.
Exemplul 2. Atunci când acțiunea unui amestec de aluminiu și fier greutate 11 g exces de acid clorhidric gazos a fost alocat 8,96 litri (STP). Se determină fracțiile masice ale metalului în amestec.
În al doilea exemplu, ambele intră reacția metalului. Acolo au hidrogen din acidul este eliberat în ambele reacții. Prin urmare, calculul directă nu poate fi utilizată aici. In astfel de cazuri, este convenabil să decidă utilizarea unui sistem foarte simplu de ecuații, luând x - numărul de moli de unul dintre metalele și pentru y - cantitatea celei de a doua substanță.
Exemplul 2 Soluție.
Găsim hidrogenul:
n = V / Vm = 8,96 / 22,4 = 0,4 mol.
Să presupunem că cantitatea de aluminiu - x mol și fier au mol. Apoi, ea poate fi exprimată în termeni de x și y, cantitatea de hidrogen:
Pentru a rezolva o astfel de sistem este mult mai convenabil metoda de scăderea, înmulțirea prima ecuație cu 18:
27x + 18U = 7,2
și scăzând primul din a doua ecuație:
(56 - 18), y = 11-7.2
y = 3,8 / 38 = 0,1 mol (Fe)
x = 0,2 mol (Al)
În continuare vom găsi masele de metal și fracțiunile lor masă în amestec:
respectiv,
ωAl = 100% - 50,91% = 49.09%
A: fier 50.91%, 49.09% aluminiu.
Exemplul 3.16 g dintr-un amestec de zinc, aluminiu și cupru sunt tratate cu o soluție în exces de acid clorhidric. 5.6 litri de gaz (STP) și o soluție de 5 g. Se determină fracțiile masice ale metalului în amestec.
In al treilea exemplu, doi de metal reacționează, și un al treilea metalic (cupru) nu reacționează. De aceea, 5g reziduurilor - este greutatea cuprului. Cantitățile de celelalte două metale - aluminiu și zinc (rețineți că greutatea lor totală 16-5 = 11 g) pot fi găsite folosind ecuațiile ca în exemplul №2.
Răspuns la Exemplul 3: 56,25% zinc, 12,5% aluminiu, 31,25% cupru.
amestec Exemplul 4.The de fier, aluminiu și cupru acționat în exces de acid sulfuric concentrat la rece. În această parte a soluției amestecului pentru a se obține 5,6 litri de gaz (STP). Amestecul rămas a fost tratat cu exces de soluție de hidroxid de sodiu. Mark și 3,36 l de gaz rămas 3 g de reziduu nedizolvate. Pentru determinarea masei și compoziția amestecului inițial de metale.
În acest exemplu, trebuie amintit că acidul sulfuric concentrat rece nu reacționează cu fier și aluminiu (pasivare), dar reacționează cu cuprul. Aceasta eliberează oxid de sulf (IV).
Reacționează numai cu un alcalin aluminiu - un metal amfoter (altele decât cele de aluminiu, substanțe alcaline solubile mai zinc și staniu, în alcalii concentrat la cald - beriliu mai fi dizolvat).
Exemplul 4 Soluție.
Cu cupru acid sulfuric concentrat reacționează numai, numărul de moli de gaz:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 mol
Numărul de moli de hidrogen:
= NH3 3,36 / 22,4 = 0,15 mol,
raportul molar între aluminiu și hidrogen de 2: 3 și, în consecință,
= 0,15 a terminalului / 1,5 = 0,1 mol.
aluminiu Greutate
MAL = n • M = 0,1 • 27 = 2,7 g
Reziduul - este greutatea de fier 3 a fost posibil să se găsească greutatea amestecului:
msmesi = 16 + 2,7 + 3 = 21,7 g
fracție de masă de metale:
A: cupru 73,73%, 12,44% aluminiu, 13,83% fier.
Exemplul 5.21,1 g de zinc și aluminiu dizolvat într-un amestec de 565 ml de soluție de acid azotic care conține 20 gr. % HNO3, având o densitate de 1,115 g / ml. Volumul gazului degajat, care este o substanță simplă, iar singurul produs al recuperării acidului azotic a fost 2,912 litri (STP). Definiți compoziția soluția rezultată în procente de greutate. (RCTU)
În textul acestei probleme sunt specificate în mod clar de recuperare de azot al produsului - „substanță simplă“. Deoarece acidul azotic cu metale previne hidrogen, este - azot. Ambele metale au fost dizolvate în acid.
Problema este rugat să nu o parte a amestecului inițial de metale, și compoziția soluției rezultate după reacția. Acest lucru face ca sarcina mai dificilă.
Soluția din Exemplul 5.
Se determină cantitatea de substanțe de gaz:
NN2 = V / Vm = 2.912 / 22,4 = 0,13 mol.
Se determină greutatea soluției de acid azotic, greutatea și cantitatea unui HNO3 dizolvat substanță:
mrastvora = ρ • V = 1,115 • 565 = 630.3 g
mHNO3 = ω • mrastvora = 0,2 • 630,3 = 126,06 g
nHNO3 = m / M = 126,06 / 63 = 2 mol
Rețineți că, metalul este complet dizolvat, apoi - cu precizie suficient de acid (cu apă, aceste metale nu reacționează). Prin urmare, va fi necesar să se verifice dacă acidul nu a fost în exces. și cât de mult a lăsat-o după reacția în soluția rezultată.
Reacțiile echivaleaza (nu uita echilibrul electronic) și, pentru comoditatea de calcul, luând peste 5x - cantitatea de zinc, și peste 10y - cantitatea de aluminiu. Apoi, în conformitate cu coeficienții din ecuațiile, moli de azot obținut în prima reacție și a doua x - molii 3Y:
Următoarea întrebare este dacă să rămână într-o soluție de acid azotic și cât de mult este lăsat?
Prin ecuațiile de reacție, cantitatea de acid, prin reacția:
nHNO3 = 0,48 + 1,08 = 1,56 mol,
și anume acidul a fost în exces și este posibil să se calculeze echilibrul soluției:
nHNO3 est. = 2-1.56 = 0,44 mol.
Deci, în soluția finală a conținut:
azotat de zinc, de 0,2 mol:
mZn (NO3) 2 = n • M = 0,2 • 189 = 37,8 g
azotat de aluminiu într-o cantitate de 0,3 mol:
MAL (NO3) 3 = n • M = 0,3 • 213 = 63,9 g
acid azotic în exces într-o cantitate de 0,44 moli:
mHNO3 est. = N • M = 0,44 • 63 = 27,72 g
Care este greutatea soluției finale?
Să ne amintim că greutatea soluției finale constă din componentele pe care le amestecat (soluții și substanțe) minus acele produse de reacție, care au ieșit din soluție (precipitații și gaze):
Suma maselor
mixt
soluții și / sau substanțe
Apoi, problema noastră:
mnov. soluție = masa de acid + aliaj metalic de masa - greutate azot
Mn2 = n • M = 28 • (0,03 + 0,09) = 3,36 g
mnov. Soluție = 630.3 + 21.1-3.36 = 648.04 g
Acum este posibil să se calculeze fracțiunea de masă a substanței în soluția rezultată:
azotat de 5,83% zinc, azotat de aluminiu, 9,86%, 4,28% acid azotic: A.
Exemplul 6. La prelucrarea de 17,4 g dintr-un amestec de cupru, fier și aluminiu în exces de acid azotic concentrat este recuperat gaz 4,48 L (STP), iar acțiunea asupra amestecului de același acid clorhidric în exces în masă - 8,96 l de gaz (STP). Se determină compoziția amestecului inițial. (RCTU)
Pentru a rezolva această problemă, este necesar să se amintească mai întâi că acidul azotic concentrat cu un metal inactiv (cupru) dă NO2. și fier și aluminiu nu reacționează cu ea. Acid clorhidric, în schimb, nu reacționează cu cuprul.
Răspuns la Exemplul 6: 36,8% cupru, 32,2% fier, 31% aluminiu.
Documente conexe:
curriculum-ul de lucru
Grad 8. §8, locuri de muncă la domiciliu 8.1. Completați în tabel, în care comparații ale sposobyrazdeleniyasmesey. Avantaje și dezavantaje sposobovrazdeleniya necesare pentru a estima costul.
Conceptul Razdeleniesmesey de substanțe razdeleniismesey și curățare. Unele dintre cele mai simple sposobyrazdeleniyasmesey. screening, razdeleniesmesey. O.S.GABRIELYAN, I.G.OSTROUMOV, A.K.AHLEBININ începe în CHIMIE Grad 7 Continuare. Începând cm. In № 1, 2, 3, 4.
Substanțe pure și amestecuri ale acestora. Sposobyrazdeleniyasmesey. Pentru a forma o idee de substanțe și amestecuri pure. Metode de purificare a substanțelor. substanțe în diferite clase de compuși organici. Caracterizat: principalele clase de compuși organici.
Evaluarea cunoștințelor studenților despre oportunitățile și substanțele sposobahrazdeleniyasmesey; formarea abilităților experimentale corespunzătoare. Clasificarea și proprietățile chimice ale substanțelor clase majore de compuși anorganici, formarea de reprezentări.
amestec. sposobyrazdeleniyasmesey. Obiective: Pentru a da o idee de substanțe și amestecuri pure; Luați în considerare amestecurile de clasificare ale acestora; Pentru a familiariza studenții cu sposobamirazdeleniyasmesey. elev și ridică card la clasa cu formula substanței anorganice.