La echilibru termic energia cinetică medie a mișcării de translație a moleculelor același gaz. In aceasta veți vedea în curând.
Energia cinetică medie a moleculelor de gaz în echilibru termic. Ia-o navă, împărțită în jumătate de un perete despărțitor, căldura conductoare. O jumătate din vasul va pune oxigen, iar celălalt - hidrogen, având temperaturi diferite. După ceva timp, gazele vor avea aceeași temperatură, independent de tipul de gaz, adică. E. Va fi într-o stare de echilibru termic. Pentru a determina temperatura afla ce cantitate fizică în teoria cinetică moleculară are aceeași proprietate.
clasa a 7-a, desigur, fizica cunoscut că moleculele mai rapide a muta, cu cât temperatura corpului. Atunci când este încălzit cu gaz într-un vas închis, presiunea crește gazului. Conform aceleiași ecuații de bază teoria cinetică moleculară (8.15) Presiunea gazului p este direct proporțională cu energia cinetică medie a mișcării de translație a moleculelor :. Când echilibrul termic dacă presiunea masei gazului și volumul sunt fixe, energia cinetică medie a moleculelor de gaz trebuie să aibă o valoare definită strict ca temperatura.
Se poate presupune că echilibrul termic este energia cinetică medie a moleculelor de același gaz. Desigur, aceasta este doar o presupunere. Ea trebuie să fie verificată experimental. Aproape imediat imposibil de a produce un astfel de test, ca să măsoare energia cinetică medie a moleculelor este foarte dificil. Dar folosind ecuația de bază a teoriei moleculare-cinetică poate fi exprimată în termeni de parametrii macroscopice.
Deoarece concentrația moleculelor de gaz. apoi din ecuația (8.15) obținem. sau
Presiunea p și volumul V sunt măsurate în mod direct. Numărul de molecule N poate fi determinată prin cunoașterea masei de gaz m. NA Avogadro constantă și molara M. masa Conform formulei (8.8)
În cazul în care energia cinetică este într-adevăr aceeași pentru toate gazele în stare de echilibru termic, iar valoarea p trebuie să fie, de asemenea, aceleași pentru toate gazele. Numai experiență poate confirma sau infirma această ipoteză.
Gaze în echilibru termic. Experiența poate fi efectuată atât. Ia câteva vase umplute cu diferite gaze, cum ar fi hidrogenul, heliu și oxigen. Vasele sunt prevăzute cu un anumit volum și manometre de presiune. Acest lucru permite măsurarea presiunii în fiecare vas. Greutățile sunt cunoscute de gaze, cunoscute astfel numărul de molecule în fiecare vas.
Aici gazele în echilibru termic. Pentru a pune acest lucru în gheață lor de topire și să aștepte până când se stabilește echilibrul termic și presiunea gazului încetează să se schimbe (figura 9.2). Ulterior, se poate argumenta că toate gazele au aceeași temperatură la 0 ° C, Presiunea gazului p. volumul V și numărul de molecule N diferite. Noi găsim raportul de hidrogen. Dacă, de exemplu, hidrogenul. cantitate dintr-o substanță care este de 1 mol, ocupă un volum VH2 = 0,1 m 3, apoi la 0 ° C sub presiune egală cu pH2 = 2,265 • 10 4 Pa. aici
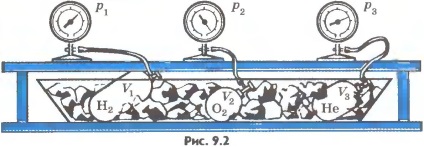
Aceeași valoare a raportului presiunii gazului acționează asupra domeniului de aplicare a acestuia se obține numărul de molecule pentru toate celelalte gaze la o temperatura de topire a gheții. Notăm acest raport de. atunci
Astfel, ipoteza noastră a fost corectă.
Cu toate acestea, raportul (9.3) nu este absolut corectă. La presiuni de sute de atmosfere în cazul în care gazele sunt foarte dense, raportul încetează să mai fie strict definite, nu depinde de volumul ocupat de gaz. Este adevărat pentru gaz, în cazul în care acestea pot fi considerate ideale.
În cazul în care vasele cu gazele introduse în apa de fierbere la presiune atmosferică normală, raportul menționat va rămâne aceeași pentru toate gazele, dar mai mult decât cea anterioară. După cum arată experiența,
Determinarea temperaturii. Prin urmare, putem afirma că valoarea crește odată cu creșterea temperaturii. Mai mult, nici una dintre care, cu excepția temperaturii este independentă. Intr-adevar, pentru un gaz ideal este independent de tipul de gaz, oricare din volumul sau presiunea acestuia, precum și numărul de particule din vas și formează nava în sine. Acest fapt experimental poate fi considerată ca o măsură valoarea temperaturii normală determinată prin alți parametri macroscopici ai gazului. În principiu, s-ar putea lua în considerare temperatura și valoarea în sine și se măsoară temperatura în unități de energie - jouli. Cu toate acestea, în primul rând, este incomod pentru utilizarea practică (temperatura de 100 ° C ar corespunde o foarte mică valoare - de ordinul a 10 -21 J), și în al doilea rând, și cel mai important, a fost mult timp obișnuit să-și exprime temperatura în grade.
Am găsit o modalitate de a obține temperatura nu depinde de proprietățile de gaze, care sunt utilizate în același timp. Până în acel moment, ne-am exprimat în unități de energie.
.
1. Pe ce bază putem presupune existența unei legături între temperatură și energia cinetică a moleculelor?
2. Cum sunt volumul, presiunea și numărul de molecule de diferite gaze în echilibru termic?
G.Ya.Myakishev, B.B.Buhovtsev, N.N.Sotsky 10 Fizică clasa
Fizica Materialelor, sarcina și răspunsuri despre cursuri, note de curs în lecția de fizică planuri pentru clasa a 10
Dacă aveți corecturi sau sugestii la această lecție, vă rugăm să ne contactați.
Dacă doriți să vedeți alte ajustări și sugestii pentru lecții, uita-te aici - Forumul Educațional.