Viteza de reacție chimică - este-nenie concentrație măsurabilă a reactanților pe unitatea de timp.

Când reacțiile omogene spațiul de reacție este notat cu volumul vasului de reacție și la eterogen - într-o suprafață pe care reacția are loc. Concentrația de substanță reacționând constituenți este de obicei exprimat în mol / l - numărul de moli de substanță în 1 litru de soluție.
Viteza de reacție chimică depinde de firi reactanților, concentrare, temperatura, presiunea, materiale de suprafață de contact și natura sa, prezența catalizatorilor.
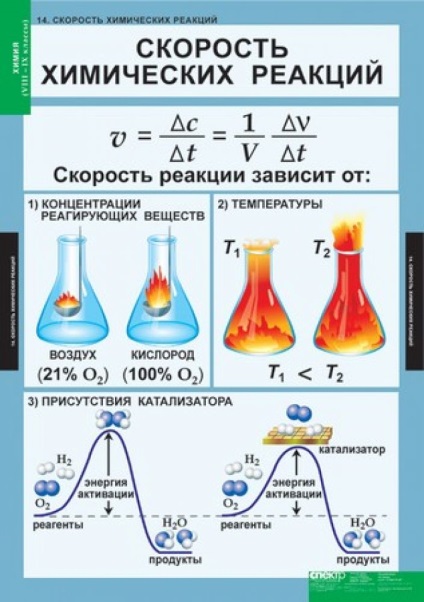
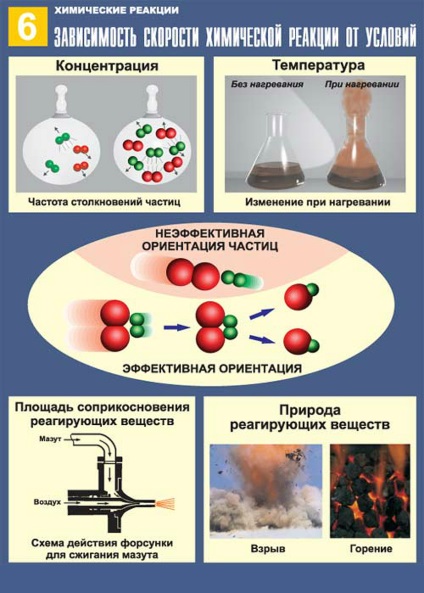
Creșterea concentrațiilor substanțelor care intră în interacțiune chimică crește viteza de reacție chimică. Acest lucru se datorează faptului că toate reacțiile chimice au loc între un număr de particule reactive (atomi, molecule, ioni). Cu cât mai mare a acestor particule în volumul spațiului de reacție, cu atât mai des se ciocnesc, și există o interacțiune chimică. Reacția chimică poate avea loc prin intermediul unuia sau mai multor evenimente elementare (coliziuni). putem scrie expresia vitezei de reacție asupra concentrației reactanților pe baza ecuației reacției. Dacă jocul evenimentului elementar doar o singură moleculă (cu reacție de descompunere), dependența podul va avea următoarea formă:
Această ecuație de reacție unimolecular. Când elementele dintr-un tară-acționează interacțiunea a două mole-molecule diferite, dependența este de forma:
Se numește reacție bimolecular. În cazul unei coliziuni a trei molecule de expresie este valabilă:
Reacția se numește trimolecular. Factori desemnări:
viteză de reacție v-;
[A], [B], [C] - concentrația reactanților;
k - factorul de proporționalitate; numitele con-constante ale vitezei de reacție.
Dacă concentrația reactanților egal cu una (1 mol / l) sau produsul lor este egal cu unu, atunci v = k. Constant depinde natura sită viteză reactanților și temperatura. Dependența ratei reacțiilor simple (.. reacții Ie apar printr-un eveniment elementar) pe concentrația descrisă de legea acțiunii de masă: SKO-creșterea unei reacții chimice, direct proporțională cu produsul concentrațiilor reactanților, gradul coș REFERINȚĂ lor stoichiometric coeficient ing- .
De exemplu, analiza 2NO reacție + O2 = 2NO2.
În cazul în care ecuația reacției chimice care nu corespunde act elementar de interacțiune, și reflectă numai legătura dintre masa și substanțele nereacționate formate, un anumit grad, la concentrații care nu este egală cu coeficienții care se confruntă cu formulele substanțelor în reacția ecuație SRI. Pentru reacția care se desfășoară în mai multe etape, viteza de reacție op redelyaetsya cea mai mică viteză (de limitare a vitezei) pas.
Această dependență a vitezei de reacție la con a centrarea reactanți este valabilă pentru gazele și reacțiile care au loc în soluție. Reacțiile implicând solide care nu sunt supuse legii acțiunii maselor, deoarece interacțiunea moleculară apare numai pe interfața top-suprafață. Prin urmare, viteza de reacție eterogen de asemenea, depinde de mărimea și natura soprikosnove suprafață TION reacționând fazelor. Cu cat mai mare suprafata - reactia va merge mai repede.
Efectul temperaturii asupra vitezei chimice re-acțiune
Efectul temperaturii asupra vitezei de reacție chimică este determinată de regula van't Hoff: temperatura mai mare-SRI la fiecare 10 ° C, reacția vitezei Uwe lichivaetsya de 2-4 ori. Matematic, aceasta este, de obicei, re-dat de următoarea ecuație:
în care vt1 și VT2 - vitezele de reacție la tem-peratures t2 și t1; g - coeficientul de temperatură - un număr-vayuschee arată de câte ori crește rata de reacție cu creșterea temperaturii, pentru fiecare 10 ° C. O astfel de dependență semnificativă a vitezei de reacție chimică la temperatură datorită faptului că formarea de noi compuși nu este deloc com coliziune a moleculelor care reacționează. Numai acele molecule interactioneaza (molecula activă), Koto-secară au suficientă energie pentru a rupe legăturile particulelor precursoare. De aceea, fiecare reacție se caracterizează printr-o barieră de energie. Pentru energia de activare escaladand molecula-MENT necesare - o parte din energie redundante, care trebuie să aibă o moleculă la coliziune cu o altă moleculă a rezultat într-o substanță nouă. Cu creșterea temperaturii, numărul de molecule active crește rapid, rezultând în viteza de reacție brusc-lea prin creșterea regula van't Hoff. Energia de activare pentru o anumită reacție depinde de natura reactanților.
Teoria ciocnirilor active pot explica influența unor factori asupra vitezei reacției chimice. Principalele prevederi ale acestei teorii:
- Reacțiile au loc în coliziune reactant de particule care au o anumită energie.
- Cu cât reactivul particulelor, cât sunt mai aproape unul de altul, cu atât mai multe șanse pe care trebuie să facă față și să reacționeze.
- În plumb reacție numai coliziuni eficace, adică cele în care rupte sau slăbite „legături vechi“ și, prin urmare pot forma „nou“. În acest scop, particulele trebuie să aibă suficientă energie.
- exces de energie minimă necesară pentru impactul efectiv al particulelor de reactiv, numit EA energie de activare.
- Activitatea chimică se manifestă într-o energie de activare scăzută a reacțiilor cu participarea acestora. Mai mică energia de activare, cea mai mare viteza de reacție. De exemplu, în reacțiile este foarte mică între energia cationi și anioni de activare, prin urmare, astfel de reacții au loc aproape instantaneu
Efectul catalizator
Una dintre cele mai eficiente mijloace de influențare a vitezei reacțiilor chimice - utilizarea catalizatorilor. Catalizatorii - substanțe care modifică viteza de reacție și se ridicau la sfârșitul procesului rămân aceleași în compoziție și greutate. Cu alte cuvinte, în momentul catalizatorului reacție este activ implicat în industria chimică pro-cesiunii, dar până la sfârșitul reactivilor de reacție schimbă compoziția chimică a acestora, transformându-se în produse, iar catalizatorul este prevăzut în prima formă, original. De obicei, un catalizator este creșterea vitezei de reacție, cu toate că unii catalizatori nu accelerează și încetinește procesul. Fenomenul accelerarea reacțiilor chimice datorită prezenței unui catalizator se numește cataliză și decelerare - inhibiție.
Anumite substanțe nu au nici un efect catalitic, dar aditivul lor crește dramatic capacitatea catalitică a catalizatorului. Astfel de substanțe sunt numite promotori. Alte substanțe (otrăvuri) reduc sau bloca chiar complet acțiunea catalizatorilor, procedeul se numește otrăvire catalizator.
Există două tipuri de cataliza: omogene și eterogene. Când omogene cataliza cu reactanții, produse și catalizator constituie o singură fază (gaz sau lichid). În acest caz, nu există nici o interfață între supra-Ness catalizator și reactanți.
Particularitatea cataliză heterogenă este acela că-congestie laminate (de obicei solide) sunt într-o altă fază SRI care constă decât reactanților și produșilor de reacție. Reacția se dezvoltă de obicei pe suprafața solidă.
Când formarea intermediarilor de cataliza omogene între catalizator și reactivul de reacție în reacția cu o activare mai mică Ener-ologie. În creșterea ratei cataliză heterogenă ca răspuns este explicată prin substanțele adsorbție constituent în suprafața catalizatorului. Ca rezultat, concentrația lor crește crește viteza de reacție.
Un caz special este autocataliză cataliza. Sensul său stă în faptul că procesul chimic accelerat de către unul dintre produsele pro-reacție.
Exemple de rezolvare a problemelor privind viteza de reacție