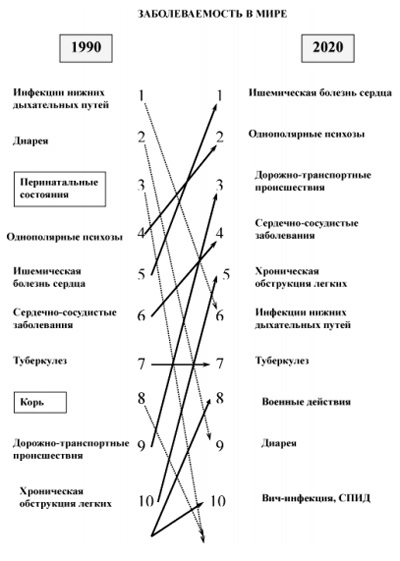
Figura 1. Mondiale a bolilor de dinamică de frecvență. Imagine a [1].
În ultimele decenii, a devenit tendință îngrijorătoare în mod clar vădită a unei populații în curs de îmbătrânire, creșterea numărului de boli și de invaliditate a persoanelor apte de muncă care necesită urgent dezvoltarea și introducerea în practica clinică de noi, mai eficiente și accesibile metode de reabilitare a pacienților. Figura 1 prezintă modul în care structura bolii în prezent.
Până în prezent, știința și tehnologia oferă mai multe modalități alternative de a restabili sau pentru a înlocui țesuturile deteriorate sau bolnave și organe patologie:
- transplant;
- implantare;
- ingineria tisulară.
Ingineria tisulara - inovații tehnologice
O abordare fundamental nouă - celule și țesuturi de inginerie - este ultima realizare în domeniul biologiei moleculare și celulare. Această abordare a deschis largi perspective pentru crearea de tehnologii biomedicale eficiente, prin care este posibil pentru a restabili țesuturile deteriorate și organe și tratamentul unui număr de boli metabolice grave la om.
Scopul inginerie tisulară - proiectare și creștere în afara corpului de viață, țesuturi sau organe pentru transplant ulterior pacientului funcționale în scopul de a înlocui sau de a stimula regenerarea tesutului deteriorate sau organe. Cu alte cuvinte, structura tesatura tridimensională care urmează să fie restaurate la locul defectului.
Este important de notat că implanturile convenționale de materiale inerte pot fi eliminate numai neajunsuri fizice și mecanice ale tesutului deteriorat - în contrast cu țesutul obținut prin inginerie, care sunt reduse, inclusiv, și funcțiile biologice (metabolice). Adică, există o regenerare tisulară, și nu doar materialul înlocuitor sintetic.
Cu toate acestea, pentru dezvoltarea și perfecționarea metodelor de medicina reconstructiva bazate pe ingineria tesuturilor necesare pentru a dezvolta noi materiale extrem de funcționale. Aceste materiale sunt folosite pentru a crea bioimplants, structuri de țesut-inginerie trebuie să caracteristici inerente conferă țesuturile vii:
- capacitatea de a se vindeca;
- capacitatea de a menține alimentarea cu sânge;
- capacitatea de a modifica structura și proprietățile ca răspuns la factorii de mediu, inclusiv stresul mecanic.
Figura 2. celulă umană primară. bibliotecă de imagini Kyokushin Federation, Yuzhnouralsk.
Celulele si Matricele - piatra de temelie pentru ingineria tesuturilor
Cel mai important element al succesului este disponibilitatea numărului necesar de celule active, funcțional capabile de a diferenția, să mențină un fenotip adecvat și îndeplini funcțiile biologice specifice. Sursa celulelor poate fi țesuturi și organe ale corpului. Posibilitatea de a utiliza celulele corespunzătoare de la un pacient care are nevoie de terapie reparatorie sau o rudă apropiată (celule autologe). Pot fi utilizate celule de origine diferită, inclusiv primar (Fig. 2) și celule stem (Fig. 3).
Figura 3. Celule stem umane. Imagine: „Planeta vie“.
Celulele primare - celule mature un anumit tesut, care pot fi luate direct din organismul donator (ex vivo) chirurgical. În cazul în care celulele primare prelevate dintr-un anumit organism donator și, ulterior, este necesar pentru a implanta aceste celule, este ca un destinatar, probabilitatea de respingere a țesutului implantat este eliminat, deoarece există eventuala compatibilitate maximă imunologică a celulei primare și destinatarul. Cu toate acestea, celulele primare, de obicei, nu sunt în măsură să împartă - capacitatea lor de reproducere și de creștere scăzută. Prin cultivarea unor astfel de celule in vitro (ingineria tisulară înseamnă) pentru anumite tipuri de celule pot dedifferentiation, adică pierderea proprietăților specifice, individuale. De exemplu, condrocite sunt introduse in cultura in afara corpului, adesea produc cartilaj fibros și netransparentă.
Deoarece celulele primare sunt în imposibilitatea de a diviza și își pot pierde proprietățile lor specifice, necesitatea unor surse alternative de celule pentru dezvoltarea de tehnologii de inginerie de celule. O astfel de alternativă la celulele stem din oțel.

Figura 4. articolele Bio-ceramice de ortofosfat de calciu. Imagine de la portalul de chirurgie osoasă.
Pentru ghidarea organizarea menținerea creșterii și diferențierea celulelor în reconstrucția celulelor tesutului deteriorate necesita suport special - matrice. reprezentând o rețea tridimensională, ca un burete sau piatra ponce (Fig. 4). Pentru a le crea aplica materiale sintetice inerte biologic, materiale pe bază de polimeri naturali (chitosan, alginat, colagen) și biocompozite. De exemplu, echivalenți de țesut osos obținute prin diferențierea direcționată a celulelor stem maduvei osoase, sângele din cordonul ombilical sau țesut adipos în osteoblaste, care sunt apoi aplicate pe diferite materiale, susținerea lor diviziune (de exemplu, matricea de colagen osos donor și colab.).
Strategia de „brand“ de inginerie de țesut
Până în prezent, una dintre strategiile de inginerie tisulara este după cum urmează:
- selectarea și cultivarea proprii sau stem donator lor celule;
- dezvoltarea unui mediu special pentru celula (matrice) bazate pe materiale biocompatibile;
- aplicarea matricei de cultură celulară și proliferarea celulelor într-un bioreactor cu condiții de cultură speciale;
- Introducerea directă a designului țesut-inginerie la organul afectat sau pre-poziționarea în bine perfused pentru maturare și formarea microcirculației în interiorul structurii (prefabricare).
Matrici în timp după implantare într-un organism gazdă dispar complet (în funcție de rata de creștere tisulară), dar numai tesut nou va ramane in locul defectului. Este de asemenea posibilă introducerea matricei cu țesutul deja format parțial nou ( „biocomposite“). Desigur, după proiectarea țesutului implant trebuie să păstreze structura și funcția pentru o perioadă suficientă pentru a restabili țesutul normal de funcționare la locul defectului și să se integreze cu tesutul din jur. Dar, din păcate, nu au fost încă create matrici comune, care îndeplinesc toate condițiile necesare.
Vasele de sânge de la imprimantă
tehnologii de țesut-inginerie prospective au deschis posibilitatea de a crea un laborator de țesuturi și organe vii, dar înainte de crearea științei organe complexe încă fără putere. Cu toate acestea, relativ recent, oamenii de stiinta condus de Dr. Gunther Produse (Gunter Tovar) al Societății Fraunhofer din Germania a făcut un progres imens în domeniul ingineriei țesutului - au dezvoltat o tehnologie pentru a crea vaselor de sange. Dar se pare că structura capilară nu pot fi create în mod artificial, deoarece acestea trebuie să fie formă flexibilă, rezistentă, mici și, în același timp, interacționează cu țesutul natural. In mod ciudat, dar în producția de tehnologii vin de ajutor - metoda de prototipare rapidă (cu alte cuvinte, 3D-imprimare). Se înțelege că un complex model tridimensional (în acest caz, un vas de sânge) este imprimat pe imprimantă cu jet de cerneală tridimensională folosind un „cerneală“ special (fig. 5).
Figura 5. „imprimare“ tehnologie de vas de sânge artificial. Imagine a [6].
Imprimanta determină straturile de material, iar în anumite locuri straturile sunt îmbinate chimic. Cu toate acestea, rețineți că imprimantele tridimensionale încă suficient de precise pentru cele mai mici capilare. În acest sens, a fost utilizată metoda de polimerizare multiphoton utilizată în industria polimerilor. Scurte impulsuri laser intense, procesarea molecula excitat materiale atât de mult încât acestea interacționează unele cu altele prin conectarea în lanțuri lungi. Astfel, materialul polimerizeaza și devine ferm, dar elastic, cum ar fi materiale naturale. Aceste reacții sunt controlate, astfel încât acestea să poată fi folosite pentru a crea structuri mici pe trei-dimensional „desen.“
Pentru crearea vaselor de sange pot andoca cu celulele organismului, la fabricarea recipientelor sunt integrate în structurile modificate biologice (de exemplu, heparina) și proteine „ancora“. În următorul pas în sistemul creează „tuburi“ sunt fixate celule endoteliale (un singur strat de celule scuamoase captuseala suprafata interioara a vaselor de sânge) - în componentele sanguine nu lipite pe pereții sistemului vascular și să fie transportat în mod liber pe ea.
Cu toate acestea, înainte de a putea fi cu adevărat implantate organe cultivate in laborator cu propriile lor vase de sange, va dura ceva timp.
Hai, România, să mergem!
Fără falsă modestie să spunem că în România, a creat o bază științifică pentru aplicarea practică a unei noi generații de materiale biomedicale. O evoluție interesantă a sugerat tânăr om de știință din Krasnoyarsk Ekaterina Igorevna Shishatskaya (Figura 6.) - polimer biocompatibil solubil Bioplastotan [7]. Esența dezvoltării sale explică pur și simplu: „In prezent, aproape medicii se confrunta cu un deficit mare de materiale capabile de a înlocui segmente ale corpului uman. Am fost capabili de a sintetiza un material unic, care este capabil să înlocuiască elementele de organe și țesuturi umane. " Ekaterina Igorevna de dezvoltare va fi utilizat în principal în chirurgie. „Cel mai simplu lucru - este, de exemplu, suturi realizate din polimer noastre, care se dizolvă după ce rana se vindeca.“ - spune Shishatskaya. - „Puteți face, de asemenea, o inserție specială în vasele - stenturi. Acestea sunt mici tuburi goale, care sunt utilizate pentru a extinde container. După ceva timp după operație nava este redusă, iar substitutul polimeric este dizolvat „[8].

Figura 6. Câștigătorul PrezidentaRumyniyaEkaterina Igorevna Premiul Shishatskaya. Imagine:. "KP" [9]

Prima experiență de proiectare transplant de țesut-inginerie a clinicii
Ca matrice altoi viitor a fost luat cadaveric segment de 7 cm lungime de trahee. Pentru a obține o matrice naturală pentru toate proprietățile superioare care pot fi realizate din tuburi polimerice, traheea a fost purificat din țesutul conjunctiv înconjurător și antigenele de histocompatibilitate donor de celule. Purificarea a constat din 25 de cicluri de devitalizare cu 4% -deoksiholata de sodiu și deoxiribonucleazei I (proces a durat 6 săptămâni). După fiecare ciclu de devitalizare a fost efectuat examinarea histologică a țesutului pentru a detecta cantitatea rămasă de celule nucleate și imunohistochimia pentru prezența histocompatibilitate HLA-Antigenii tesut ABC, HLA-DR, HLA-DP și HLA-DQ. Datorită bioreactorul de proprietate (vezi. Fig. 9), oamenii de știință de pe suprafața unui segment de rotație lent al traheei cauzate de seringa celula uniform suspensie. Apoi, grefa, jumătate cufundat în mediul de cultură, rotit în jurul axei sale de contact alternativ celulele cu mediul și aer.
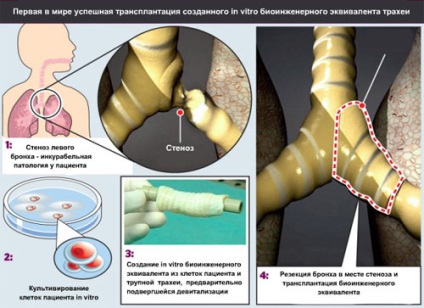
Figura 8. Operația pentru transplant de un pacient trahee. Imagine de la [10].
trahee echivalentă a fost de 96 de ore în bioreactor; atunci este transplantat la pacient. În cazul în care operațiunea a fost eliminat complet Secțiunea principală bronhiilor și traheei stângă la care a aparținut. In rezultat grefa gap vshili și o nepotrivire de diametre de lumeni bronhie tisulare echivalente și destinatarul a fost depășită datorită elasticității donatorului de tesut.
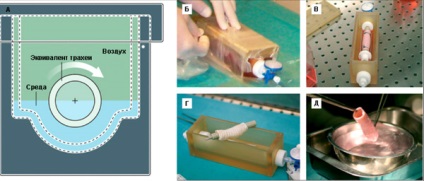
Figura 9. bioreactor este de a genera traheei-tesut echivalent. A - bioreactor vedere laterală. B - bioreactor de etanșare. B - bioreactor cu tesut-echivalent in trahee situ. G - bioreactor după îndepărtarea traheal echivalent. D - tip trahee echivalent imediat înainte de intervenția chirurgicală. Imagine de la [11].
După zece zile după operație pacientul a fost externat din clinica fara semne de boală respiratorie și răspunsul imun de respingere a grefei. Conform Tomografia computerizata, prin care 3D virtual de reconstrucție a cailor respiratorii tesut echivalent a fost practic imposibil de distins a fost făcută pacientului bronhiile propriu (Fig. 10).
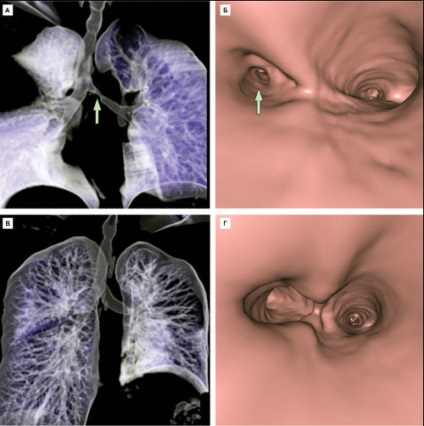
Figura 10. Virtual 3D-reconstrucție a tractului respirator prin tomografie computerizată și bronhoscopie, înainte de etapa (A, B) și 1 lună după înlocuirea porțiunii de țesut echivalent stenotic principal bronhia stanga (B, D). Săgeata indică stenoza. Imagine de la [11].