MKT bază ecuația
Temperatura. temperatura absolută
Temperatura Relația cu energia cinetică medie a moleculelor de substanță
Micro - macroparameters și starea de gaz
Un sistem format dintr-un număr mare de molecule, numite macrosystem. Macrosystem separate de pereții corpurilor exterioare cu caracteristici constante după o lungă perioadă de timp vine în echilibru. Această stare poate fi descrisă printr-un număr de parametri, numite parametri de stat. Distinge microparameter și starea Macroparameters.
Prin microparameters condiție poate include următoarele mărimi fizice: masa M 0 molecule, viteza lor, viteza efectivă a moleculelor, energia cinetică medie a moleculelor, timpul mediu între ciocnirile moleculelor, calea lor liber mediu etc. Acestea sunt parametrii care pot fi atribuite unuia. molecula macro.
Macroparameters de stat caracterizează doar sistem de echilibru în ansamblu. Acestea includ volumul presiunii P. T. V. Densitatea Temperatura , concentrația energiei interne U. N. parametri electrici, magnetice și optice. Valorile acestor parametri pot fi setate prin instrumente.
Teoria moleculară-cinetică a gazului ideal dacă se potrivește cu macroparameters microparameters și gaze.
Tabel. stat Mikroparametry
gaz Prepararea amestecare în masă sau volum predeterminat
Ecuația fundamentală a teoriei moleculare cinetice a gazelor ideale
Această ecuație se referă la macroparameters sistemului - presiune P și concentrare molekulS microparameters sale - greutatea moleculară, viteza lor medie pătratică sau energia medie cinetică:
Această ecuație se bazează pe ideea că moleculele ideale de gaze se supune legilor mecanicii clasice, iar presiunea - este raportul dintre forța medie în funcție de timp, cu care moleculele lovesc de perete, în zona peretelui.
Proporționalitatea forței cu care molecula expusă pe perete, concentrația lor, masa și viteza fiecărei molecule calitativ înțeles. Creșterea presiunii pătratic la o rată legată de faptul că, la viteza depinde nu numai de pini de alimentare separată, dar, de asemenea, frecvența ciocnirilor moleculare cu peretele.
Având în vedere relația dintre concentrația de molecule din gazul și densitatea acesteia ( = Nm 0) se poate obține o altă formă a ecuației MKT gazului ideal de bază:
Temperatura. temperatura absolută
Fig. 2. termometre lichide
La contactul dintre cele două sisteme macro, dintre care fiecare este în echilibru, de exemplu, atunci când deschiderea robinetului între două recipiente izolate termic cu gaz sau contactați prin perete conductor termic, echilibrul este rupt. După o perioadă lungă de timp, în unele părți ale sistemului integrat, noi valori ale parametrilor de sistem sunt stabilite. Dacă vorbim doar despre Macroparameters, apoi temperaturile organelor.
Termenul „temperatura“ a fost introdus în fizică ca mărime fizică ce caracterizează gradul de organismul nu este încălzit de senzațiile subiective experimentator, și pe baza unor dovezi obiective de dispozitive fizice.
Termometru - instrument de măsurare a temperaturii, a cărui acțiune se bazează pe un sistem de conectare unu la unu parametrul observat (presiune, volum, conductivitate, luminozitate luminiscență, etc ...) Cu temperatură (figura 2.).
Se crede că, dacă acest parametru secundar (de exemplu, cantitatea de mercur într-un termometru cu mercur), în timpul contactului prelungit cu corpul si un contact prelungit cu un alt corp de același, aceasta înseamnă că temperatura egală cu cele două corpuri. In experimente pentru a stabili distribuția vitezei de molecule a fost demonstrat că această distribuție depinde numai de gradul de căldură a corpului, așa cum este măsurată cu un termometru. În natură modernă fizica statistică a energiei particulelor sistem de distribuție caracterizează temperatura.
Pentru a calibra termometrul necesar temperatura corpului, care este considerată a fi constantă și reproductibilă. De obicei, această temperatură de echilibru gheață - sistem de apă la presiune atmosferică (0 ° C) și punctul de fierbere a apei la presiunea atmosferică (100 ° C).
În temperatura SI exprimată în grade Kelvin (K). Pe această scală de la 0 ° C = 273,15 K și 100 ° C = 373.15 K. În utilizarea de zi cu zi și alte scară de temperatură.

Ecuația Mendeleev - Clapeyron (ecuația de stare de gaz ideal)
Ca urmare a studiilor experimentale de către mulți oameni de știință s-a constatat că gazele macroparameters reale nu pot fi schimbate în mod independent. Acestea sunt legate de stat:
În cazul în care R = 8,31 J / (K · mol) - constanta universală a gazelor, unde M - masa gazului și M - masa molară a gazului. Ecuația Mendeleev - Clapeyron-numita ecuație de stat. deoarece conectează funcționale opțiuni suplimentare de stare relație. Rezultatele lui în alte forme:
Folosind ecuația de stare, se poate exprima un parametru peste altul și complot primul dintre ele, ca a doua funcție.
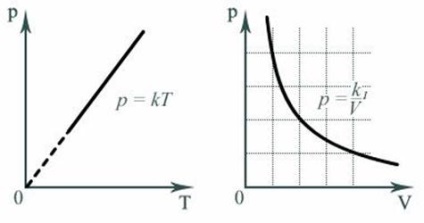
Graficele de un parametru de altul, construit la o temperatură, volum și presiune fixă, respectiv numit izotermă. Isochors și isobars.
De exemplu, dependența de presiune P temperatura T la volum constant V și o masă constantă de gaz M - este o funcție, unde K - factor numeric constant. Graficul unei astfel de funcții în coordonatele P, T este o linie dreaptă care rulează de la origine ca graficul funcției Y (x) = kx în Y coordonatele, x (fig. 3).
Dependența presiunii P V a volumului la o constantă masa gazului M și temperatura T este exprimată după cum urmează:
,
În cazul în care K 1 - factorul numeric constant. In graficul coordonatele Y, x reprezintă o hiperbolă, precum și în graficul de P, V coordonatele.
Temperatura Relația cu energia cinetică medie a moleculelor de substanță
Relația cantitativă dintre temperatura T sistemul (macroparameter) și moleculele de gaz ideale medie a energiei cinetice (microparameter) poate fi dedus dintr-o comparație a ecuației de bază gaz ideal ecuația MKT de stat și unde J / K - constanta Boltzmann. Comparând cele două expresii pentru presiunea, obținem
Energia cinetică medie a unui gaz ideal de molecule este proporțională cu temperatura gazului. În cazul în care moleculele de gaz sunt formate de două, trei, și așa mai departe. G. Atomi, se dovedește că această expresie se leagă numai energia mișcării de translație a moleculei ca întreg și temperatura.
Având în vedere acest raport la nivel micro - și macroparameters macro poate argumenta că într-o stare de echilibru termic între cele două sisteme sunt aliniate la temperatură și un gaz ideal, energia cinetică medie a moleculelor.