Cristalele sunt formate din elemente diferite și având un tip de grilaj diferit de elementele constitutive ale matrice numite faze intermediare. Faze intermediare sunt compuși chimici mai frecvente.
Chemicals - o fază de compoziție constantă formate cu metale sau nemetale cu elemente care prezintă proprietăți intermediare.
Ele sunt caracterizate printr-un simplu multiplu al raportului dintre elementele care ne permite să-și exprime tipul lor o formulă. Tues.
Proprietățile compușilor chimici diferă în mod semnificativ de proprietățile elementelor sale constitutive.
V.№20 diagramele de echilibru de fază în sistem cu două componente: descrierea,. Conceptul de termeni figurative. regulă de fază pentru a determina modelele de schimbare a numărului de faze într-un sistem eterogen. Conceptul de invariantului și monovariant.
Atomii din compuși chimici sunt aranjate ordonat, formarea de compuși chimici este însoțită de un efect termic semnificativ.
Diagrame de fază de echilibru în sistemele binare.
proceselor de cristalizare și transformări de fază descrie aliajele folosind diagramele de fază de echilibru, care arată grafic compoziția fazei și structura aliajului în funcție de temperatură și concentrația componentelor. Diagrama construit temperatura coordonatele concentrațiilor, fiecare punct de pe scală corespunde unui raport de concentrație a componentelor A și B.
Capetele concentrației scalei corespund componentelor pure A și B.
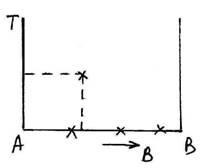
Orice punct de pe diagrama de fază caracterizează faza a compoziției aliajului la o temperatură dată și se numește punct figurativ.
diagrame de stare ne permite să determinăm compoziția fazei la echilibru, adică, când a avut loc toate conversie posibile. Această stare a aliajului depinde de condițiile: temperatură, presiune. Și caracterizată prin numărul și concentrația fazelor rezultate.
Modelul de schimbare a numărului de faze într-un sistem de faze heterogen determină regula.
Faza Regula - definește raportul dintre numărul de grade de libertate, numărul componentelor și numărul de faze și este exprimată prin ecuația: C = K + P-F
unde C - numărul de grade de libertate,
K - numărul de componente
R - numărul factorilor externi
Sub multe grade de libertate înțeleg numărul variabilelor independente (temperatură, presiune, concentrație) la care schimbarea nu modifică numărul de faze în echilibru.
Atunci când studiază o serie de factori de metal presiune externă unitate de primire, luând în considerare doar temperatura, deoarece presiune are o influență redusă asupra compoziției fazei, apoi în mod tipic faza: G = K + 1-F
Dacă numărul de grade de libertate este egal cu 0, sistemul este numit konvamantnoy la aliaj konvamantnom echilibru a unui anumit număr de faze pot exista numai în anumite condiții de perfectă, adică la o temperatură constantă.
Dacă numărul de grade de libertate egal cu 1 se numește monovariant echilibru dacă C = 2, bivariate.
Diagrama V.№21 a sistemului în care componentele sunt infinit solubile în stare solidă. Regiunea pe diagrama de fază. Conceptele liniei lichidus și linia solidus. Caracteristici ale cristalizarea soluțiilor solide.