Sodiu (Natrium); Al. Greutate 22.991. După cum sa indicat deja, sau sodiu metalic se obține prin electroliza hidroxid de sodiu topit, la care se adaugă circa 12% bicarbonat de sodiu sau electroliza clorurii de sodiu.
Aparate pentru prepararea soluției de hidroxid de sodiu este prezentată în Fig. 140. Iron navă 1 poate găzdui până la 200 kg de NaOH și vmazat cuptorul este încălzit din exterior gazele încălzite pentru a menține hidroxidul de sodiu în stare topită. catod groasă este nichel sau cupru tijă 2 care trece prin fundul vasului, anod - catod cilindru nichel 3 este înconjurat de un grilaj de fier deasupra care trece în cilindrul de fier 4, închis capacul. mesh Scop - pentru a preveni pătrunderea de sodiu emiși la anod.
In procesul de electroliză, se acumulează topit sodiu fier în interiorul cilindrului, unde este scobit periodic și turnate în formă.
La oxigenul anod se dezvoltă datorită descărcării ionilor hidroxil.
Apa rezultată se evaporă aproape în întregime, dar, cu toate acestea, o parte din ea se descompune curent, prin care la catod este eliberat simultan cu sodiu și hidrogen.
De mare interes este prepararea clorurii de sodiu lennogo-sodiu în topitură, deoarece în acest caz soda caustică este înlocuit scump produs considerabil mai ieftin - sare de masă.
Baie de NaCl electrolitic (Fig. 141) constă dintr-o carcasă de fier 1, suprapus pe interior cu cărămizi refractare. Grafitul anod 2 este înconjurat de un catod de nichel 3, pereții exteriori sunt acoperite cu un material izolant electric. Sub clopotul 4 este șicană reticular 5 acoperind catod. Sodiul metalic este colectat în spațiul inelar și catod prin tubul 6 trece în colector 7. Clorura de sodiu a fost încărcat prin gaura din baia de capac.
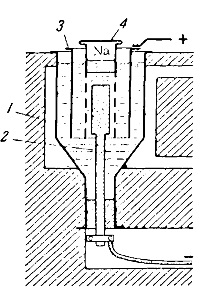
Fig. 140. Aparat pentru producerea de sodiu metalic de NaOH: 1 - vas de reacție; 2 - un catod; 3 - un anod; 4 - cilindru de fier cu ochiuri și capac
Un dezavantaj al metodei este necesitatea de a efectua procesul la o temperatură relativ ridicată (610-650 °), care necesită echipament destul de complex.
În stare liberă de sodiu este un argintiu sp metal alb. greutate 0.97, care se topește la 97,7 °. Sodiu este atât de moale, este ușor de tăiat cu un cuțit. Deoarece-oxizi de lumină lyaemosti sodiu aer stocat, de obicei, sub un strat de parafină.
sodiu metalic are o utilizare destul de răspândită. Acesta servește ca materie primă în producerea de peroxid de sodiu și amidă de sodiu, și este utilizat în multe sinteze ale compușilor organici. In laboratoarele de sodiu este adesea utilizat pentru a îndepărta ultimele urme de umiditate din anumiți solvenți organici.
Deoarece formele de mercur de sodiu un aliaj solid - amalgam de sodiu, care este uneori folosit ca agent de reducere în loc de metal pur.
Deoarece oxigenul sodiu formează doi compuși: oxid de sodiu Na2 O Na2 O2 și peroxid de sodiu.
oxid de sodiu Na2 O poate fi obținută prin trecerea peste sodiu încălzită nu mai mare de 180 °, o cantitate moderata de oxigen sau peroxid de sodiu prin încălzire cu sodiu metalic:
oxid de sodiu reacționează violent cu apa pentru a forma hidroxid de sodiu și izolarea cantitatea mare de căldură:
Na2 peroxid de sodiu O2 se formează în timpul arderii de sodiu în aer sau oxigen. În condițiile din fabrică, peroxid de sodiu se prepară prin încălzirea de sodiu metalic în caserole de aluminiu plate, amplasate într-o țeavă de fier, prin care curentul de aer este trecut eliberat de dioxid de carbon. Produsul rezultat are forma de pulbere gălbuie și conține aproximativ 93% Na2 O2.
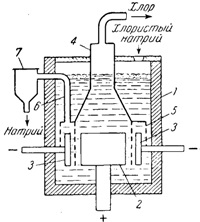
Fig. 141. Aparat pentru producerea de sodiu metalic de NaCl: 1 - carcasă de fier; 2 - anod; 3 - un catod; 4 - clopot; 5 - partiția mesh; 6- tub; 7 - o colecție
peroxid de sodiu are un foarte puternic proprietăți oxidante. Multe substanțe organice în contact cu ea aprinde.
Sub peroxid de sodiu blând dizolvat în soluție obținută apă rece care conține hidroxid de sodiu și apă oxigenată. Să ne amintim că toate peroxidul este considerat în prezent ca sare a unui acid foarte slab - peroxid de hidrogen. Prin urmare, interacțiunea dintre peroxid de sodiu cu apă substanțial reprezintă hidrolizarea sarea formată un acid slab și o bază tare:
Dacă soluția rezultată a fost încălzită, apoi datorită descompunerii peroxidului de hidrogen, oxigen din acesta.
Când acțiunea acidului peroxid de sodiu diluat poate fi obținut și peroxid de hidrogen.
Datorită formării de peroxid de hidrogen la dizolvarea Na2 O2 în apă sau acizi diluați, peroxid de sodiu este utilizat pe scară largă pentru țesături albire, lână, mătase, paie, pene și m. P.
reacție importantă dintre peroxid în dioxid de carbon Tria:
O 2 Februarie - + 2e - = 2O -
În această reacție, folosirea peroxidului de sodiu pe bază în măști, precum și în submarine izolatoare pentru absorbția dioxidului de carbon expirat de către oameni și simultan reaprovizionarea tip acru în aer.
NaOH oxid de sodiu hidrat este o substanță solidă, de culoare albă, foarte higroscopică, care se topește la 328 °. Din cauza efectului coroziv puternic pe materialul textil, piele, hârtie și alte substanțe organice este numită soda caustică ( „soda“ vechi nume de oxid de sodiu).
Apa se dizolva hidroxidul de sodiu, cu eliberarea unei cantități mari de căldură din cauza formării diferitelor hidrați.
soda caustica trebuie depozitate în recipiente bine sigilate, deoarece absoarbe cu ușurință dioxidul de carbon din aer, transformă treptat în carbonat de sodiu.
Metoda de bază de producere a NaOH este electroliza soluție apoasă de clorură de sodiu. Când un curent este trecut din evacuarea catodului
ionii de hidrogen și acumularea simultană a ionilor hidroxil rezultând într-un hidroxid de sodiu; clor la anod este eliberat. Este important ca produsele de electroliză nu a putut fi amestecat deoarece altfel hidroxidul de sodiu reacționează cu clor pentru a forma NaCI și NaClO:
2NaOH + Cl2 = NaCI + NaClO + H2O
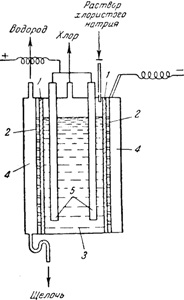
Fig, 142. Schema de baie electrolitică cu o deschidere verticală;
1 - diafragmă; 2 - un catod; 3 - compartimentul anod; 4 - spațiul catodic; 5- anozi
Există mai multe metode pentru a preveni pătrunderea clorului în soluție de hidroxid de sodiu. Cel mai frecvent utilizat diafragmennyysposob, în care spațiile anodice și catodice sunt separate printr-un perete despărțitor din azbest. În băile electrolitice, care servesc la obținerea de hidroxid de sodiu pentru această metodă (Fig. 142), montat vertical diafragmă 1 situată aproape de catod de fier perforat 2, 3 separă spațiul anod la catod 4. Anozii sunt tije din grafit 5. In procesul de electroliza anod spațiu furnizat în mod continuu o soluție de clorură de sodiu, și curge din soluția catod care cuprinde un amestec de NaCl
și NaOH. La evaporarea și clorură de sodiu cristalizată este o soluție aproape pur alcalină. Ultimul fuzionat cu NaCI și se evaporă pentru a îndepărta complet toată apa. Rezultat alcaline exprimate topit și în forme. Produsele rezultate în prepararea de hidroxid de sodiu sunt clor și hidrogen.
Mai multe fluxuri diferite soluții de electroliză de NaCl, dacă catod este mercurul metalic. În acest caz, nu se descarcă la catod, ionii de hidrogen și ionii de sodiu. Eliberat, sodiu se dizolvă în mercur, formând aliajul topit, așa-numitul amalgam de sodiu. Apa caldă se degradează ușor amalgamul, în care soda caustică obținută, hidrogenul este eliberat și mercurul eliberat. Astfel, folosind mercur ca un catod, este posibil să se obțină hidroxid de sodiu absolut pur care nu conține impurități nedescompus clorură de sodiu.
Fig. 143 prezintă o schemă de flux pentru producerea de sodă caustică prin metoda cu mercur. Instalația este alcătuită din două părți - celula 1, în care are loc formarea de amalgam de sodiu,
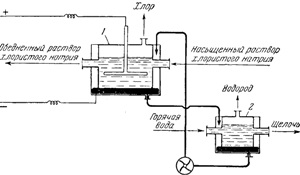
Fig. 143. Circuit pentru obținerea de hidroxid de sodiu metoda Hg
Pe lângă procesul electrolitic pentru producerea de hidroxid de sodiu. uneori folosit încă metoda mai veche - soluție de sodă cu var hidratat de fierbere:
După reacție, soluția a fost decantată din precipitatul de carbonat de calciu și se evaporă apă, rezultând topită soda caustică.
soda caustica este una dintre cele mai importante produse de bază ale industriei chimice. mondială anuală (cu excepția URSS), pentru a dezvolta aceasta depășește 6,5 mil. tone. Cazare si vinde acesta ajunge numit sodă caustică. mare cantitate de hidroxid consumată industria petrolieră de sodiu, în care NaOH este utilizat pentru purificarea produselor petroliere, industria de săpun, hârtie, textile, producția de fibre sintetice, precum și o serie de alte industrii.
Producerea de hidroxid de sodiu în URSS 1955 au totalizat 563,400. G, mai mult de 10 de ori mai mare decât producția de sodă caustică în pre-revoluție România. În 1959-1965 ,. Producerea de sodă caustică este planificată să crească de mai multe ori în comparație cu 1955
sare de sodiu. Formele de săruri de sodiu pentru toți acizii cunoscuți. Deoarece cele mai importante săruri de sodiu și aplicațiile lor au fost descrise cu acizi adecvați, aici îi amintim numai.
Toate pătată torță flacără de sodiu în galben. Această reacție face posibilă detectarea prezenței sumelor mai nesemnificative de sodiu din substanța de testat.