Chimia studia moduri particule subatomice interacționează unele cu altele atomi ce formează. Chimia de asemenea, analizeaza procesele atomilor din molecula compusului. electroni atom In interiorul jurul nucleului sunt aranjate în așa numitele orbitali de electroni. Fiecare coajă orbital poate găzdui o anumită cantitate de electroni. Când plicul următor este umplut complet, noi electronii incep sa se formeze cele ce urmează, mai îndepărtat de carcasa de bază, și totuși este umplut complet. Astfel, electronii crea noi coajă în jurul nucleului; atom mai greu, cu atât electronii și coji de electroni pe care le are. Când doi atomi împreună în moleculă, electronii interacționează unele cu altele prin încorporarea în cochilia de electroni nu este complet umplut atom adiacent. Ca și în cazul formării unui singur înveliș de electroni dintr-un atom in molecula este mai întâi umplut cu următorul orbitale disponibile, iar procesul continuă, implicând posturi vacante mai îndepărtate. După ce am citit acest articol, veți învăța cum să calculeze multiplicitatea legăturii chimice.
pași Editare
Metoda 1 de la 2:
Se determină lipirea și orbitali antibonding Editare
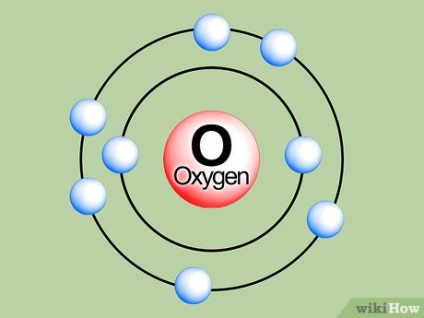

Uită-te la diagrama de cochilii orbitale electronice. Aceste diagrame sunt date în manualele și manualele de chimie. După cum se poate observa, fiecare shell este la o distanță de nucleu atomic. Din moment ce fiecare sistem închis tinde la o stare de energie minimă (o proprietate cunoscut sub numele de entropie), electronii vor tinde să umple atât o coajă orbital mai mic posibil.
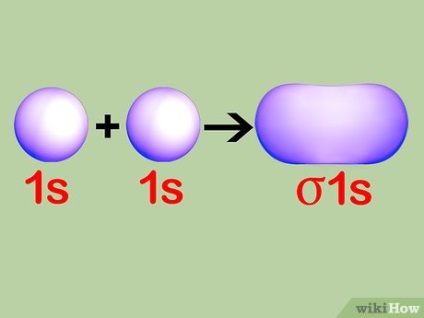

Conceptul de orbitali de unire. Atunci când doi atomi au tendința de a crea o moleculă, ei încearcă să folosească reciproc electroni completați nivelurile inferioare ale libere în cochilii lor orbitale. În funcție de gradul de umplere a cochiliilor orbitale fiecare atom poate determina câte un atom de electroni într-o stare cu energie mai mare vecin va umple spațiul liber în carcasele din al doilea atomilor de joasă energie. Aceste orbitali sunt numite lianți.
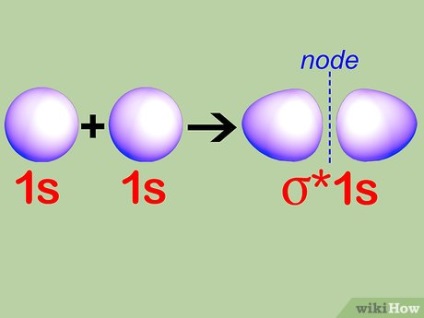

Conceptul de antibonding orbitali. Atunci când doi atomi formează molecula prin schimbul de electroni, unii electroni trebuie să fie deplasat într-o energie mai mare, deoarece orbital cu toate stările de energie joasă sunt deja ocupate. Aceste orbitali sunt numite antibonding orbitali.
Metoda 2 din 2:
Găsirea multitudinea drepturilor de comunicare
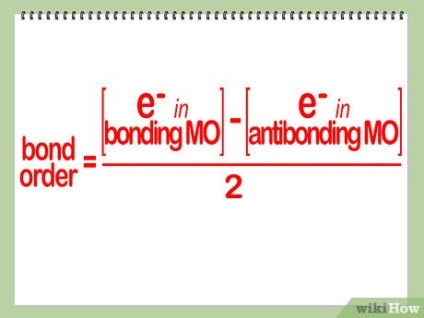

Se determină starea energetică a compusului chimic format. Fiecare electron a plasat pe moleculele de legare orbitale vor contribui la întărirea legăturii moleculare. Pe de altă parte, fiecare electron este situat pe orbitalii antibonding, acesta va destabiliza molecula. Definiți o nouă stare de energie, împărțind cu 2 diferența dintre cantitatea de lianți și electroni de dezintegrare (adică electroni situate pe orbitalii respective).


starea de energie S-au găsit și o multitudine de conexiune a moleculei. Dacă multiplicitatea conexiunii este zero, o astfel de moleculă nu poate fi formată. Cu cat mai mare multitudinea de comunicații, mai stabil molecula.
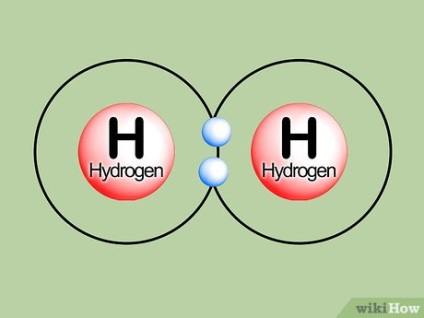

Să considerăm un exemplu simplu. Un atom de hidrogen în stare neutră are un electron dispus la s shell. Aceasta carcasa poate ține doi electroni. Atunci când doi atomi de hidrogen sunt unite împreună, fiecare oferă electron pentru a umple mantaua s doilea atom, și ca rezultat se formează două lipirea orbital. Electronii nu trebuie să se mute în orbitali superior următor p coajă, astfel încât sunt formate orbitalii antibonding. Astfel, multitudinea de comunicații este egal (2-0) / 2 sau 1. forme cunoscute molecula de H2 hidrogen gazos.