Fig. multiplicitate de comunicare 168- Efect (n), pe distanța DE internuclear
obligațiuni multiple. Până în prezent, ne-am uitat la molecule cu legături simple. t. e. o moleculă numai la o legătură. Cu toate acestea, o mult mai diversă de molecule și ioni complexe. multiplicitatea medie (ordine), în care conexiunea este mai mare decât unu. Îmbunătățirea multiplicitate de comunicare obligat să impună obligațiuni de obligațiuni și b articolul I. De exemplu, într-o moleculă de N2, având o legătură triplă [c.77]
Descrie structura electronica a moleculelor de CO și SH din poziția metodelor de soare și MO. Care dintre molecule caracterizate printr-o multitudine mai mare de comunicare [c.61]
Comparați relațiile multiplicitate și proprietățile magnetice și Rs moleculare IOIA moleculă E 2. [c.61]
Exemplul 2. Pentru a compara proprietățile magnetice ale multiplicității și legături F în moleculă, și p2 ion. Într-o energie mare de legare a particulelor trimit cererile lor electronice. [C.60]
Bazat pe frecvențele vibrațiilor de valență. putem calcula constantele de forță. Acestea din urmă depinde de natura atomilor legați și multiplicitatea conexiunii (tab. 14). [C.146]
conexiune multiplicitate în astfel de cazuri poate fi reprezentat prin următoarea formulă [c.164]
Multitudinea conexiunilor este respectiv - -2-iod E1 energia de legare la E este mai mare decât F în moleculă,. [C.60]
Aetod MO permite definirea unei proceduri așa-numita, sau o multitudine de comunicare ca jumătate din numărul de electroni la svyazyvayu- [c.58]
considerare Scurt rezumat al celor mai simple reprezentanți ai alcani. alchenă și alchină. Odată cu creșterea multiplicitate de comunicare crește puterea sa de ansamblu, scurtarea distanței C-C. Cu toate acestea, datorită prezenței de n-etilen și legături acetilenă diferă de la labilitate chimic etan. Și schimbarea simultană a legăturii C-H în acești compuși. Metoda SYH care poate fi asociată cu o schimbare în natura hibridizării orbitalilor atomului de carbon din această serie (sp în etan și etilenă în sp sp în acetilenă) din lungimea sa este scurtat, puterea este crescută, astfel încât nu capacitatea de protonare. Caracteristicile de obligațiuni este prezentată în Tabelul. 9. [c.110]
Structura electronică a moleculei N2 a fost luată în considerare în Sec. 2.5. I-Legătura dintre atomii de azot (față de carbon) și legături mai puternice (ua Fig. 3.43 linia E, în funcție de multitudinea de comunicații pentru legături carbon-carbon este pliat în jos, și pentru -până legături azot-azot, care a cauzat mai mare decât carbon nucleu atomic încărcare N. În formarea unui singur nucleu și comunicare [c.394]
Dată fiind multiplicitatea legăturii CH este de 1 s, .H = 0,5-1 0,5-1 + 1 = [c.171]
Conform chimice acceptate reprezentări valență atom A poate fi determinată ca suma multiplicitatea legăturile formate de acei atomi. Apoi, folosind formula (65), putem scrie [c.170]
Diferențele în conexiunile multiplicitate C H CH = CH-CH = CH, [c.174]
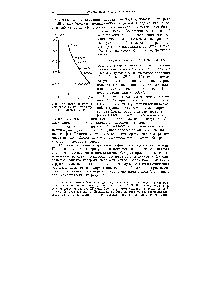
Lungimea legăturii între atomii 2 și 3 este mai puțin 1,54A datorită densității de electroni crescută a legăturii care are o anumită multiplicitate. Multiplicitatea acestei legături poate fi găsită în butadienă grafic (Fig. 42), cunoscând multitudinea legăturilor și vechimea în muncă diferite hidrocarburi [c.112]
În general, energia de legătură între doi atomi dat depinde de multitudinea de comunicații și metoda de saturație a altor atomi aceste valențele, m. E. Pe ordinea cu care atomii sau grupări atomice ele sunt asociate. Odată cu creșterea multiplicitate - trecerea de la o conexiune simplă la o dublă și o legătură triplă - întotdeauna puternic caracter obligatoriu crește de energie. Dar, la o anumită multitudine de diferențe minore în metodele de conectare, saturație a altor valențele atomilor este mai slab afectează energia de legare luate în considerare. [C.84]
Multitudinea de comunicare. Pluralitatea comunicării datorită impunerii unei n- legătură și 6 legături. De exemplu, într-o moleculă, imeyushih, este o legătură triplă [c.71]
Rasstiyanie între atomii de carbon cu creșterea multiplicitate Scădeți comunicare-shaets1 și este în mod adecvat 0.1543 0.1353 și 0.1205 nm. [C.77]
Cartea este o cuprinzătoare și ușor de înțeles, și cel mai important punct de vedere metodologic corect introduce teoria legăturii chimice și rezultatele aplicării sale la descrierea structurii și proprietăților compușilor din diferite clase. În primul rând a prezentat idei de pre-cuantice J. Lewis de valență (Lewis ovyh) structuri și arată că deja pe baza reprezentărilor despre socializarea perechilor de electroni și o regulă octetul simplă prin utilizarea raționamentului logic despre multitudinea de relații și a taxelor formale este posibilă fără calcule matematice complexe, cum se spune pe degete. pentru a explica structura și proprietățile multor molecule. În esență, acest lucru începe cu introducere în chimia modernă pătrunde în toate punctele de vedere și termenii uneia dintre cele două abordări principale ale teoriei cuantice a structurii chimice, metoda de legături de valență (BC). Din păcate, în ciuda simplitatea și recursul intuitivă a acestor idei, metoda soarelui este foarte complicată și computational nu permite calitativ pentru a rezolva problema energiei stărilor electronice ale moleculelor. fără de care este imposibil de a judeca cu privire la structura lor. Prin urmare, sub teoria cuantică a legăturii chimice este prezentată în principal în cadrul unei abordări metodă diferită de molecular orbital (MO). În exemplul de molecule biatomice a intrat teoria cheie de reprezentare OM de suprapunere și de nivelurile de energie orbitale ale MO, caracterul lor obligatoriu și proprietăți nodale. precum simetria MO. Toate aceste construcții se termină diagrame generalizate pentru MO și molecule biatomice homonucleare Goethe -royadernyh discuții și cu ajutorul lor structura și proprietățile multor sisteme specifice în același timp devine clar că unele dintre proprietățile moleculelor (de exemplu, magnetice) pot fi explicate numai pe baza teoriei cuantice MO. Teoria Urmatoarea MO este aplicat la molecule poliatomice. și, în unele cazuri, aceasta se face în termeni de MO localizate (similar cu ideea direcția metodei legăturilor de soare) și proiectarea lor este introdus hibridizării orbitalilor atomici. în timp ce în altele, trebuie să recurgă la delocalizat MO. Discutarea acestor probleme se termină secțiunea interesantă scrisă a posibilităților de spectroscopie moleculara la determinarea structurii compușilor principiilor aici sunt explicate spectroscopiei vibraționale [C.6]
Chimie generală în formulele, definiții, scheme (0) - [c.57. c.70]
Chimie generală în formulele, definiții, scheme (1985) - [c.57. c.70]
Chimie generală în formulele, definiții, scheme (0) - [c.57. c.70]
Fundamentele teoretice ale Organic Chemistry (1973) - [c.140]