ecuația Arrhenius. energia de activare
Conversia particulelor precursoare în produșii de reacție, de obicei, asociate cu depășirea barierei potențial, care se numește energia de activare a unei reacții chimice (E).
Prezența bariera de potențial, datorită faptului că fiecare particulă (moleculă, ion radical) - este mai mult sau mai puțin energic formarea stabilă. Restructurarea speciilor reactive necesită ruperea sau slăbirea legăturilor chimice individuale, cu privire la necesitatea de a cheltui energie. Raportul dintre particule cu energie mai mare decât E este e - E / RT (legea Boltzmann). Transformarea chimică implică doar acele particule a căror energie este mai mare decât E, deci reaktsiik rată constantă
e - E / RT. Pentru prima dată zavisimostkot T Arrhenius derivate din datele experimentale. Ea are forma
Această formulă constă din doi parametri: factor pre-exponențială (factor pre-exponențial) A. E energie de activare și activare Energia este energia în exces minim, care ar trebui să aibă o particulă (sau un cuplu de particule reactive) pentru a intra în reacții chimice. Exponent e - E / RT reprezintă fracțiunea de particule active sau particule de coliziune activă rezultând în reaktsii.Predeksponentu Amozhno considerate o rată constantă la care specia activă reacționează. După cum este ușor de văzut, k = A la E = 0 ik aCând → T → ∞.
legea Arrhenius poate fi derivată din teoria termodinamica echilibrului chimic în următoarele ipoteze:
1) O transformare in molecule produse precede tranziția la o modificare activă, care necesită cheltuieli de energie E;
2) acest molecule active Aakt modificare este format printr-un proces reversibil: A ↔ Aakt.
Kakt = [A] act / [A]; unde într-un fel - constanta de echilibru;
3) Concentrația de molecule active modificabile A este foarte mică, astfel încât formarea lor este, practic, nu se schimbă concentrația moleculelor inițiale, însă Aakt Kakt = [A];
4) modificarea activă transformată în produsul final la o rată care este independentă de temperatură, adică constanta vitezei de reacție chimică
deoarece, potrivit termodinamica, dlnKakt / dT = + E / RT 2.
dlnk / dT = d lnKakt / dT = E / RT 2 sau
lnk = - (E / RT) + const.
Punerea = const lna, unde A - o constantă independentă a temperaturii, avem
lnk = lnA- (E / RT) ilik = Ae - E / RT.
Din această concluzie, condiții clare în care o reacție chimică simplă urmează legea Arrhenius. In primul rand, activarea moleculelor are loc numai datorită energiei termice. În cazul în care moleculele sunt excitate de particule încărcate de lumină, etc. legea Arrhenius nu poate fi realizată. În al doilea rând, fluxul de reacție nu trebuie să perturbe echilibrul distribuției energiei a gradelor de libertate a particulelor reactive (condiția 2).
Dependența vitezei de reacție la temperatură este uneori exprimată ca coeficient de temperatură. Coeficientul de temperatură a (T) arată de câte ori crește rata de reacție chimică, cu creșterea temperaturii de 10 K:
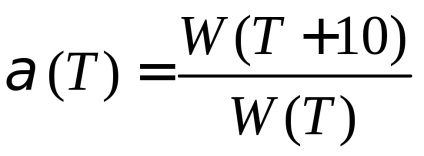
Pentru unele reacții elementare, cum ar fi recombinarea atomilor, ioni și radicali, E
