Vaporii oricărei substanțe este saturată numai în cazul, în cazul în care, împreună cu ea, în sistem există fluid liber. Un amestec format dintr-un lichid volatil cu vaporii de saturație este sistemul univariant a cărui stare este caracterizată prin, sau de presiune sau temperatură.
In cazul in care pentru a menține o temperatură predeterminată într-un sistem cu două faze, presiunea de vapori este determinată strict ?? ennym. În cazul în care suportul a fost determinat ?? presiunea vaporilor de ennoe, existența simultană a lichidului și vaporilor va fi posibilă numai în ennoy temperatură determinată ??. De ex Sun ?? volatile dependența de presiune a vaporilor de lichid a temperaturii în coordonatele p și t (evaporarea curba) are aproximativ aceeași formă - convexitatea orientată axa temperaturii (figura 4).
Figura 4 - Curba de evaporare
Luați în considerare dependența de volum a presiunii pentru un sistem care constă din (de exemplu, propan), lichid și vapori la forța de comprimare izotermă (Fig. 5a).
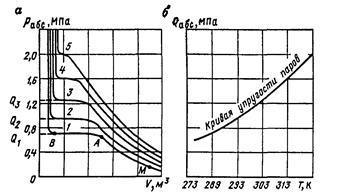
Figura 5 - Dependența presiunii și temperaturii asupra cantității de (a) și elasticitate a curbei de vapori saturați (b):
Temperatura, K 1-283; 2-293; 3-303; 4-313; 5-323
La comprimarea de la M la A, există un nesaturată (supraîncălzit) cu abur, iar curba are forma unui hiperbolă. În acest caz, presiunea asupra produsului volumului specific în primă aproximație este constantă. La punctul de vapori devine saturat și comprimarea ulterioară devine fluid (secțiunea AB), presiunea sistemului nu este schimbat, astfel încât volumul său este redusă din cauza transferului de vapori la starea lichidă. La punctul B, finisajele de tranziție de vapori într-un lichid și la comprimarea ulterioară a volumului său este redus ușor, cu o creștere bruscă a presiunii. Porțiunea orizontală AB corespunde schimbării presiunii în timpul condensării fazei de vapori în faza lichidă. Amplitudinea acestei presiuni este numită elasticitatea vaporilor saturați (Q) de gaze naturale, la o temperatură predeterminată. Trebuie remarcat faptul că mai aproape de temperatura critică, cea mai mică porțiunea orizontală.
De obicei, astfel de teste au fost efectuate la temperaturi diferite. Mai aproape de temperatura critică, porțiunea orizontală mai scurtă de a exprima elasticitate turnat vapori. Consolidarea în continuare a presiunii în curba axelor - (. Figura 5, b) temperatura în conformitate cu presiunea de vapori saturați, și curba de evaporare astfel obținută sau curba presiunii de vapori a substanței.
Pentru diferite curbe de presiune a vaporilor de hidrocarburi saturate prezentate în Fig. 6.
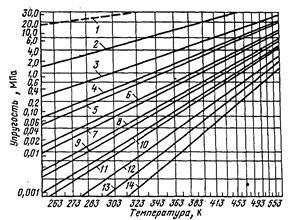
Figura 6 - Curbele saturate Presiunea de vapori a hidrocarburilor pure:
1 - metan; 2 - 3 etan - propan; 4 - izobutan; 5 - butan; 6 - izopentan; 7 - pentan; 8 - izohexan; 9 - hexan; 10 - isoheptane; 11 - heptan; 12 - octan; 13 nonanului 14 - decan
Pentru hidrocarburi la presiunea vaporilor saturați pură Q depinde numai de temperatura t. E. Q = f (t). În aceste condiții, presiunea vaporilor saturați este egală cu presiunea totală pe suprafața lichidului; la această temperatură, presiunea nu poate crește sau descrește.
Presiunea totală pentru un amestec de hidrocarburi compuse din presiunile parțiale ?? componente ex Sun. În acest caz, presiunea de vapori saturați a oricărei componente nu rămâne constantă la o temperatură dată, și este, de asemenea, o funcție a presiunii totale, ᴛ.ᴇ. Q = f (t, p). Deoarece, în acest caz, există trei variabile (presiunea, temperatura și presiunea de vapori), se introduce o constantă K așa-numitul echilibru (coeficientul partiționat Eniya ??) reprezentând presiunea vaporilor raportul Q la PCM presiune totală
Rezultatul poate fi reprezentată grafic pentru determinarea ?? Eniya constanta de echilibru (și, prin urmare, de asemenea, la presiunea vaporilor). De exemplu, la presiuni scăzute, constanta de echilibru este schimbat aproape în linie dreaptă, deoarece presiunea vaporilor aproape constantă. La presiuni ridicate cresc presiunii vaporilor, cu o creștere a presiunii totală devine considerabilă. Acest lucru este exprimat printr-o linie dreaptă în curba de tranziție (vezi. Fig. 7).
Cu creștere suplimentară a curbei presiunii se apropie de punctul de inversare, în care creșterea elasticității este egală cu presiunea totală. Apoi, presiunea vaporilor crește mai mare de presurizare și în această regiune constanta de echilibru K crește cu o creștere a presiunii, care este cauzată de o creștere a volatilității lichidului. Acest fapt arată două valori valoarea de echilibru schimbările constante cu o modificare a presiunii.
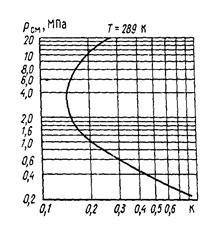
Figura 7 - Dependența dintre constantele de echilibru ale n-butan, la 289 K din presiunea totală
a se vedea, de asemenea,
Elasticitate (presiunea vaporilor) hidrocarburi caracterizează presiunea la care gazul începe să se condenseze și să devină hidrocarburi lichide sostoyanie.U individuale de presiune a vaporilor pur (Qi) este o funcție numai de temperatură: Qi =. [Citește mai mult].