Reacțiile de oxidare-reducere sunt reacții care apar odată cu schimbarea gradului de oxidare a elementelor.
Oxidarea este procesul de recul a electronilor de către un atom
Recuperare - procesul de primire a electronilor de către un atom
Agentul de recuperare este un element care eliberează electroni
Agentul de oxidare este un element care ia electroni
Pentru o reprezentare vizuală, dar simplificată a cauzelor modificării sarcinilor în elemente, să analizăm cifrele:
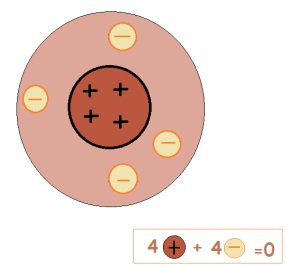
Un atom este o particulă neutră din punct de vedere electric. Prin urmare, numărul de protoni este egal cu numărul de electroni
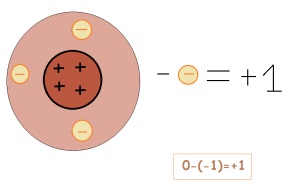
Dacă un element dă un electron, atunci încărcarea lui variază. Ea devine încărcată pozitiv (dacă este nevoie, dimpotrivă, este negativă)
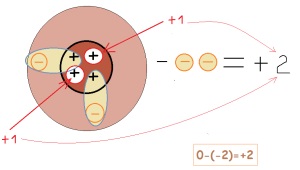
astfel încărcarea unui element este afectată de numărul de electroni trimiși sau primiți
I. Compilarea ecuațiilor reacțiilor de oxidare-restaurare
1. Scrieți schema de reacție
Na + Cl2 → NaCI
2. Aranjăm gradul de oxidare a elementelor:
Na 0 + Cl 2 0 → Na + Cl -
3. Scriem elementele care au schimbat gradul de oxidare și determină numărul de electroni trimiși / primiți:
4. Găsiți cel mai mic număr comun de numere ale electronilor atașați și atașați: