Dacă precipitantul este volatil, se recomandă să se folosească de două - trei ori excesul său; dacă precipitantul este nevolatil, se folosește un exces de 30-50%.
Se calculează volumul unei soluții de azotat de argint de 2% cu o densitate de 1 g / ml, necesar pentru precipitarea anionului clorurat dintr-o probă de CaCl2 · 6H2O cu o masă de 0,4382 g.
Se găsește masa de azotat de argint necesară pentru a precipita anionul de clorură sub formă de clorură de argint.
Folosim legea echivalenților:
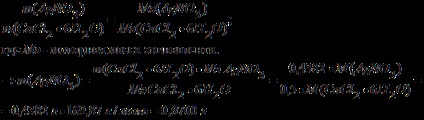
Să găsim masa unei soluții de azotat de argint de 2%:
Volumul soluției este egal cu greutatea soluției, deoarece densitatea soluției este de 1 g / ml. În consecință, volumul soluției este de 34,00 ml.
Ce volum de soluție 5% de azotat de argint cu o densitate de 1 g / ml este necesar pentru a precipita clorura de argint din 200 ml dintr-o soluție de acid clorhidric 0,01 M.
Se găsește masa de acid clorhidric în 200 ml de soluție 0,01 M.
Gasim masa de azotat de argint conform legii echivalentelor:
Se găsește masa unei soluții de azotat de argint de 5%.
Volumul soluției de 5% este egal cu greutatea soluției, deoarece densitatea soluției este egală cu 1 g / ml. În consecință, volumul soluției este de 6,8 ml.
Pentru o depunere mai completă, se ia un exces de 30% din precipitator:
Soluție = 6,8 ml; 1,3 = 8,84 ml.
Se calculează masa unei soluții de acid sulfuric de 5% pentru a precipita plumbul din 0,5865 g din probă cu o fracție de masă de plumb de 12%.
Observăm masa plumbului în eșantion:
Găsim o masă de acid sulfuric pur pentru precipitarea plumbului. Folosim legea echivalenților:
Se găsește masa unei soluții de acid sulfuric de 5%:
Se determină volumul unei soluții 2% de 8-hidroxichinolină cu o densitate de 1 g / ml, luată cu un exces de 10%, pentru a precipita complet 8-hidroxichinolatul de magneziu din 100 ml dintr-o soluție conținând 50 mg de magneziu.
Cantitatea de precipitat poate fi găsită prin legea echivalenților sau prin ecuația de reacție:
MgCl2 + 2C9H6NOH Mg (C9H6NOH) 2 + 2HCI
Se calculează volumul soluției de precipitare:
Greutatea soluției este egală cu volumul soluției, deoarece densitatea este de 1 g / ml. În consecință, volumul soluției este de 7,5 g • 1 g / ml = 7,5 ml. Volumul soluției precipitante luate cu un exces de 10% este de 7,5 ml • 1,1 = 8,25 ml.