În condițiile de ardere a combustibilului industrial, starea de echilibru nu are loc de obicei. Viteza de reacție poate fi determinată prin oricare dintre rata de conversie a reactanților, astfel încât rata de ardere poate fi exprimată în funcție de rata de consum a elementelor de combustibil sau combustibil în ansamblu, precum și prin rata de consum a oxidantului sau rata de produse de combustie.
Dependența ratei reacției chimice la temperatură
Cu o temperatură în creștere, rata reacției de combustie chimică crește. Pentru a determina dependența ratei reacției chimice de temperatură, este suficient să se determine dependența de temperatură a constantei. Această dependență este exprimată de legea lui Arrhenius.
unde E - energia de activare (kJ / mol), R - constanta de gaz (8.314 kJ / mol), KO - factor de pre-exponențială (numărul total de coliziuni moleculare), T - temperatura absolută a procesului.
Energia suficientă pentru a distruge legăturile intramoleculare ale substanțelor inițiale se numește energia de activare E. Cu cât este mai mare nivelul energiei de activare, cu atât viteza de reacție este mai lentă.
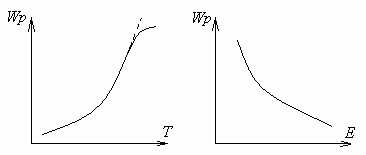
Figura 1.7 - Dependența ratei de reacție asupra temperaturii și a energiei de activare
Energia de activare este factorul principal care determină viteza de reacție: cu cât este mai mică energia de activare, cu atât viteza este mai mare.
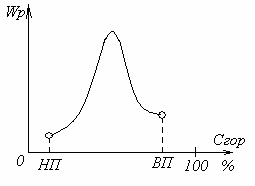
Dependența ratei reacției chimice la concentrația amestecului