0 (t) <0, в правой части выражения (1.90) R> 0, T> 0, deci prima derivată a logaritmului constantei de echilibru în raport cu temperatura este negativă
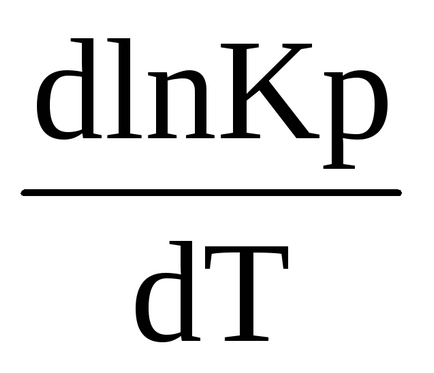
Pentru procesul endotermic Δr H 0 (τ)> 0 derivatul logaritmului constantei de echilibru în raport cu temperatura este pozitiv (
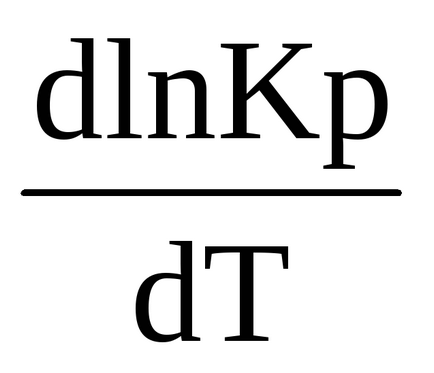
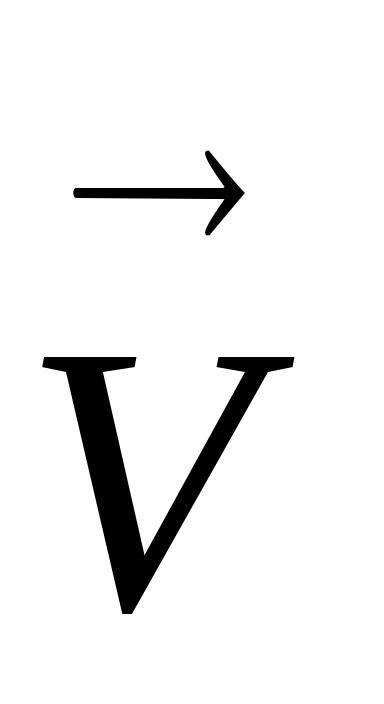
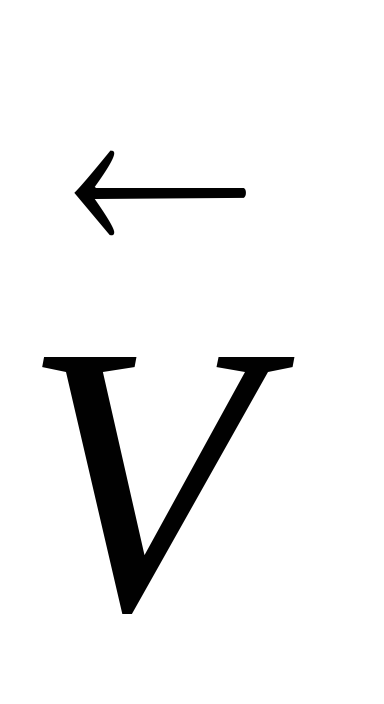
Prin principiul Le Chatelier, când concentrația unuia dintre participanții la reacție se schimbă, echilibrul este mutat spre schimbarea compensatoare, adică cu o creștere a concentrației uneia dintre substanțele inițiale - în partea dreaptă și cu concentrație crescătoare a unuia dintre produsele de reacție - în stânga. Dacă substanțele gazoase participă la reacția reversibilă, atunci când presiunea se modifică, toate concentrațiile se schimbă în mod egal și simultan. Viteza proceselor se schimbă și, în consecință, poate apărea o schimbare a echilibrului chimic. Astfel, de exemplu, când presiunea (în comparație cu presiunea de echilibru) este mărită de un sistem de CaCO3 (K)
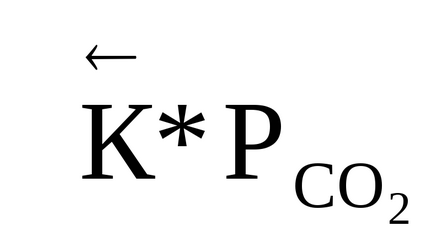
Pentru sistemul 4HCl + O2
Astfel, în conformitate cu principiul Le Chatelier, atunci când crește presiunea, echilibrul se îndreaptă către formarea unei cantități mai mici de moli de substanțe gazoase în amestecul de gaze și, respectiv, în direcția reducerii presiunii în sistem.
Dimpotrivă, atunci când presiunea externă determină o scădere a presiunii, echilibrul se îndreaptă către formarea mai multor moli de substanțe gazoase, ceea ce va determina o creștere a presiunii în sistem și va contracara efectul produs.
Principiul Le Chatelier are o mare importanță practică. Pe baza ei, este posibilă selectarea unor astfel de condiții pentru interacțiunea chimică care să asigure randamentul maxim al produselor de reacție.