Există patru tipuri principale de reacții care implică compuși organici: substituție (deplasare), adăugare, eliminare (clivaj) transpoziție.
3.1 Reacții de substituție
In primele reacții de substituție de tip are loc, de obicei, la un atom de carbon, dar atom substituit poate fi hidrogen sau oricare alt atom sau grup de atomi. În substituția electrofilă adesea înlocuit cu un atom de hidrogen; exemplu este substituția aromatică clasică:
Când de multe ori nu substituția nucleofilă a înlocuit un atom de hidrogen și ceilalți atomi, de exemplu:
NC - + R-Br → NC-R + BR -
3.2 Reacția plus
reacție de adiție poate fi, de asemenea tip electrofilă, nucleofil sau radical, în funcție de particula inițierea procesului. Atașarea unui legături convenționale duble carbon-carbon este indusă, în mod tipic un electrofil sau un radical. De exemplu, aderarea HBr
Se poate începe cu un atac al legăturii duble proton H + sau un radical Br ·.
3.3 Reacțiile de eliminare
reacția de eliminare este în mod esențial inversul reacției de cuplare; cel mai frecvent tip de astfel de reacție - scindarea unui atom de hidrogen și un alt atom sau grup de atomi de carbon adiacenți pentru a forma alchene:
3.4 rearanjare
Rearanjări poate proceda prin compuși intermediari care sunt cationi, anioni sau radicali; cele mai multe dintre aceste reacții continua cu formarea carbocationilor sau a altor electroni particule. Rearanjare poate include o restructurare substanțială a scheletului de carbon. Pe parcursul etapei de rearanjare în sine, în astfel de reacții urmează adesea etapa de substituție, adiție sau clivaj rezultând într-un produs final stabil.
Descrierea detaliată a etapelor de reacție chimică numit mecanism. Un punct de vedere electronic al reacției chimice în mod de a înțelege mecanismul de rupere a legăturilor covalente în moleculele și secvența de stat, prin care reactanții înainte de transformarea în produsele de reacție.
4.1 reacție cu radicali liberi a
Reacțiile radicalilor liberi - sunt procese chimice, care implică molecule având electroni nepereche. Anumite aspecte ale reacțiilor radicalilor liberi sunt unice în comparație cu alte tipuri de reacții. Principala diferență constă în faptul că multe dintre reacțiile radicalilor liberi sunt lanț. Aceasta implică existența unui mecanism prin care o multitudine de molecule transformată în produs folosind un proces iterativ, stabilirea inițiat de un particule reactive. Un exemplu tipic este ilustrat prin următorul mecanism ipotetic:
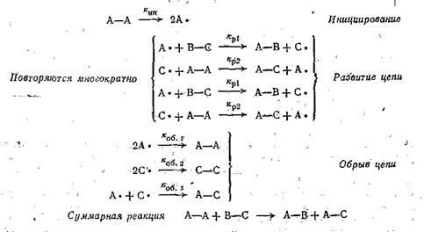
Etapa în care reacția intermediară este generată în acest caz, A +, se numește inițiere. Această etapă se realizează la o temperatură ridicată, prin UV sau peroxid, în solvenți nepolari. Următoarele patru ecuațiile acestui exemplu este secvență de două reacții repetate; ele reprezintă lanțul de faza de dezvoltare. Reacțiile în lanț sunt caracterizate printr-o lungime a lanțului, care corespunde numărului de pași pe o singură etapă de inițiere. A doua etapă are loc în timp ce sinteza compusului și formarea unui nou radical care continuă lanțul de transformări. Ultimul pas este un pas al unui circuit deschis, care include orice tip de reacție care rupe unul dintre intermediarii de reacție, necesare pentru dezvoltarea lanțului. Cu cât pașii de terminare a lanțului, cu atât mai mic devine lungimea lanțului.
reacțiilor radicalilor liberi au loc: 1) lumină, la temperatură ridicată sau în prezența radicalilor care sunt formate în timpul descompunerii altor substanțe; 2) a inhibat substanțe reacționează ușor cu radicalii liberi; 3) să aibă loc în solvenți nepolari sau în faza de vapori; 4) au adesea perioadă autocatalitică și o inducție înaintea reacției; 5) în legătură cu lanțul kinetic sunt.
reacții de substituție radicale caracteristice alcanilor și adăugarea radical - pentru alchenei și alchinei.
CH3 -CeCH + HCI → CH3-CH = CHCI
Conexiunea dintre radicalii liberi și o terminare a lanțului are loc în principal pe pereții reactorului.
4.2 reacția Ionic
Reacție, care are loc în ruperea legăturii heterolitice și forma particule intermediare de tip ionic, numite reacții ionice.
Reacții ionici apar: 1) în prezența catalizatorilor (acizi sau baze și nu sunt afectate de lumină sau de radicali liberi, în special, care rezultă din descompunerea peroxizi); 2) nu sunt afectate de captatori de radicali liberi; 3) în cursul reacției este influențată de natura solventului; 4) apar rar în faza de vapori; 5) sunt cinetic substanțial reacțiile de prima sau a doua ordine.
Prin natura reactivului, molecula activă, reacțiile ionice sunt împărțite în electrofile și nucleofile. Reacțiile de substituție nucleofilă sunt caracteristice halogenuri de alchil și arii,
substituție electrofilă - pentru alcanilor în prezența catalizatorilor