Faza este colectarea uniformă, identică în părțile lor din proprietățile de sistem. În anumite condiții (p și T) două faze diferite ale aceleiași substanțe pot exista în echilibru. Există, de asemenea, punctul în care cele trei faze pot fi în echilibru (punctul triplu). Trecerea de la o etapă la alta se numește o tranziție de fază. tranziții de fază sunt însoțite de absorbția sau eliberarea de căldură (căldura latentă de tranziție de fază) numita fază de tranziție de primul tip. Există, de asemenea, un ordin a doua fază de tranziție, în care nu există absorbție sau de căldură, iar unii parametri modificați brusc (tranziții între modificări cristaline, trecerea la starea supraconductoare, etc.).
tranziție lichidă în stare gazoasă se numește evaporare. procesul invers se numește condensare. Tranziția către starea gazoasă a unui solid este numit sublimare.
q căldură, care trebuie raportată la greutatea unitară a substanței pentru ao transforma în abur, situat la aceeași temperatură, care a fost substanța să se evapore se numește căldura specifică de vaporizare (sau sublimare). Când căldura de condensare luat evaporativ date fiind format invers în timpul lichidului de condensare (sau solid) este încălzit.
Evaporarea (sublimare) apar până echilibrul între gaz și lichid (și gazul rezidual solid). Atunci când o anumită presiune pentru o temperatură dată, numărul de molecule, lăsând lichidul și revenirea să devină egale. Din acest punct, densitatea de vapori încetează să se schimbe. Între lichid și vapori se stabilește un echilibru dinamic, care va exista atâta timp cât nu se va schimba cantitatea sau temperatura sistemului. Aburul, care este în echilibru dinamic cu lichid său, numit saturat. Presiunea la care se produce echilibru, numit presiunea (sau elasticitatea) a aburului saturat. Presiunea vaporilor saturați crește cu temperatura.
Luați în considerare în procesul de comprimare a gazelor la temperatură constantă (adică, se obține o izotermă gaz real). Inițial, cel puțin, să reducă volumul de presiune a gazului va crește (figura 1). La atingerea volumului presiunii Vr încetează să varieze și o parte din gazul condensează într-un lichid. Separarea Substance are loc în două faze: o fază lichidă și gazoasă. reducerea cât mai departe porțiunea creșterea volumului de gaz trece în faza lichidă, în care tranziția are loc la o presiune constantă CHP (presiunea vaporilor saturați). Posletogo ca substanțe capete de proces de condensare (când volumul Vl), în continuare începe reducerea volumului însoțit de creșterea rapidă a presiunii.
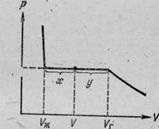
Raportul în greutate de lichid și vapori în stare de două faze este raportul dintre segmentele pentru care împart un punct porțiune izotermă orizontală reprezentând starea.
Figura 2 prezintă izotermele la mai multe temperaturi. Figura arată că odată cu creșterea temperaturii izotermei porțiune orizontală este redusă, trăgând un punct, numit punct critic. Corespunzătoare celei a temperaturii Ta. Volumul Vcr. presiune este, de asemenea, numit PKR valoarea critică. Rețineți că, odată cu creșterea temperaturii scade densitatea lichidului, iar aburul saturat este crescut și punctul critic al diferenței între lichid și vapori saturați dispare (lichid și vapori densități devin egale). Gazul peste temperatura critică nu poate fi transformată în lichid
Noțiunea de temperatură critică a fost introdusă pentru prima dată D. I. Mendeleevym. El a numit temperatura absolută a lichidului la fierbere și privit ca temperatura la care forța de adeziune dispare între moleculele și lichidul se transformă în vapori.
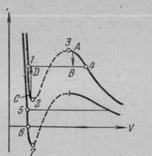
Figura 3 suprapus izotermă a izotermei reale și van der Waals. Dintr-o comparație a izotermelor forțe Van der Waals cu izoterma real aceasta implică faptul că acestea sunt aproximativ aceleași în zonele corespunzătoare stării de fază unică a substanței (gaz și lichid), dar se comportă foarte diferit în separarea în două faze (unde există vapori și lichid saturate) . În loc în formă de S curl izotermei Van der Waals izotermei reală are în această zonă o porțiune orizontală dreaptă.