Osmoza numita mișcare spontană a solventului printr-o membrană permeabilă la solvent și impermeabil la solut (membrana semipermeabila) din soluție mai puțin concentrată la mai concentrată.
În toate cazurile pe care le considerăm ca solvent va acționa ca apa. Astfel, apa se mișcă, de unde mai mare (soluție concentrată mai puțin), acolo unde este mai mică (soluție mai concentrată). procesele osmotice au loc în prezența unei membrane semipermeabile permeabilă numai la solvent - apă. membrane semipermeabile datorită prezenței în ea are anumite proprietăți și dimensiuni, în care molecula cu unele proprietăți și dimensiuni pătrund prin ea, iar pe de altă parte - nu penetrează. Este important să nu numai mărimea moleculelor, dar proprietățile lor fizice și chimice, deci este posibil ca moleculele mai mari trec prin membrana si mai mici - nu va funcționa. Deoarece practic toate corpului membranei - procesele semipermeabile, osmotice aceasta determina întreaga sa activitate de viata.
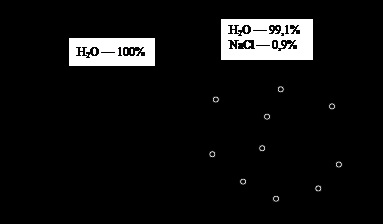
Fig. 2. Osmoza. Explicații în text
Pentru osmoza ilustrări descrie un experiment simplu (Fig. 2). Luați flaconul cu apă distilată și împărțiți-l printr-o membrană semipermeabilă în două părți egale. Desigur, acest lucru nu va provoca nici un fenomen nou în vas, ca pe ambele părți ale membranei are un singur solvent. Solubil în orice parte a navei o substanță (pentru definiteness, să fie într-o concentrație fiziologică de NaCl - ≈ 0,9%). Pe ambele părți ale membranei apar gradientului de concentrație existentă în substanțele vasului: apă și NaCl. Este firesc să presupunem că pentru a începe o amestecare spontană de substanțe care duc la egalizarea concentrației în ambele jumătăți ale vasului. Cu toate acestea, membrana semipermeabila nu trece solut, și nu se poate deplasa dintr-un loc cu o concentrație mai mare în cazul în care concentrația este mai mică (în cazul nostru - zero). Prin urmare, mutarea poate doar apa - dintr-un loc unde mai mare (concentrație 100%), într-un loc unde este mai mic (≈ 99,1%). Cât timp va fi procesul? Experimentul demonstrează în mod concludent că în cele din urmă se oprește mișcarea apei, și trebuie să aflăm de ce. Pentru a face acest lucru, vom efectua următorul raționament.
Pe măsură ce apa se mișcă, trebuie să existe unele cauze de forță să se miște. Când mișcarea se oprește, înseamnă că există o altă, care este egală în mărime și opusă în direcția, forța care împiedică continuarea mișcării. Ce este această putere? Referindu-ne la Fig. 3.
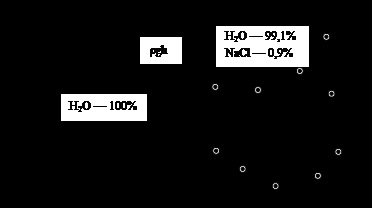
Fig. 3. Osmoza. Explicații în text
În procesul de mutare a nivelului de lichid al solventului, în partea stângă a figurii este redusă, iar dreapta - la fel de mult îmbunătățit. Aceasta conduce la o diferență în presiuni hidrostatice în ambele jumătăți ale vasului egal # 961; gh, unde h - diferența de înălțime a coloanelor de lichid în cele două părți ale navei. Când h atinge valoarea care asigură o presiune egală și oppositely îndreptat forțele de presiune de conducere a solventului prin membrana, mișcarea acestuia se oprește. Amploarea acestei presiuni este egală cu presiunea osmotică a soluției fiind în jumătatea dreaptă a navei. Dacă dorim să prevenim imediat transferul solventului prin membrană, ar fi necesar să se aplice o soluție (dreapta jumătate a vasului) o presiune egală cu presiunea osmotică a soluției (fig. 4).
Presiunea osmotică a soluției egală cu presiunea care urmează să fie aplicată la o soluție pentru a preveni deplasarea acestora solventul pur.
Presiunea osmotică poate fi definită după cum urmează:
este presiunea la care solventul pătrunde în soluție prin membrana semipermeabilă.
Firește, presiunea osmotică este detectată numai în prezența unei membrane permeabile numai la solvent.
Ca și în orice presiune, presiunea osmotică poate fi măsurată în atmosfere. mm Hg. Art. Pascali. mm apă. Art. etc. Cu toate acestea, nu toate aceste unități sunt ușor de utilizat. Astfel, presiunea sanguină osmotică exprimată în atmosfere, mediile 6,62 atm. (Desigur, în dreptul isoosmolar, aceeași presiune va fi, în alte sectoare ale organismului). Prin urmare, o altă unitate de măsură a fost aleasă pentru exprimarea presiunii osmotice. Înainte de a ajunge la o cunosc, vom descrie un alt experiment.
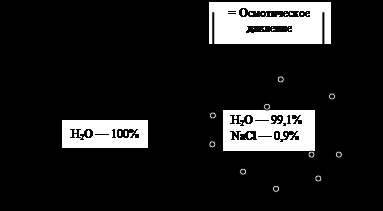
Fig. 4. Osmoza. Explicație în text
Să considerăm din nou vasul nostru, împărțit în jumătate de o membrană semipermeabilă, din care o parte a fost o soluție fiziologică de NaCl și este solubil în altă parte, de exemplu, glucoza la 5,5% (mai precis - până la 5.544%) concentrațiile (Figura 5.).
În ciuda diferenței concentrațiile de substanțe pe fiecare parte a membranei, deplasarea solventului (apă), nu se observă, după cum reiese cu prisosință de experimentul [1]. Lipsa mișcării solventului înseamnă că presiunea osmotică a soluției pe ambele părți ale membranei sunt egale, cu toate că densitatea lor de masă și, prin urmare, densitatea, este diferită. Prin urmare, o astfel de modalitate de exprimare a concentrației (în procente de volum) nu reflectă presiunea osmotică a soluției.
Are lungi diverse soluții de cercetare fizice și chimice au demonstrat că presiunea osmotică depinde numai de numărul particulelor de solut (molecule, ioni) și nu depinde de proprietățile lor (mărime, masă, sarcină electrică, etc.). Deci, avem nevoie de o unitate care reflectă cantitatea de particule. O astfel de unitate este cârtița. 1 mol de orice substanță are o masă, exprimată în grame, este numeric egală cu greutatea moleculară a materialului, care poate fi găsit prin căutarea în tabelul periodic. De exemplu, 1 mol de carbon are o masa de 12 g, fier - 56 g, oxigen - 32 g de (16 + 16, deoarece molecula de O2 este format din doi atomi). Mai grea particula (molecula), 1 mol de material mai dur, pliat din aceste particule (molecule). Dar cel mai remarcabil în această unitate care 1 mol de orice substanță conține același număr de molecule egal ≈ 6,02 # 8729, Octombrie 23 (numărul lui Avogadro). Prin urmare, este clar că, din moment ce presiunea osmotică a soluției depinde de numărul de particule dizolvate, iar această sumă poate fi exprimată prin numărul de moli de substanță, presiunea osmotică poate fi (și este convenabil!) Pentru a exprima o concentrație molară a soluției (osmolaritate).
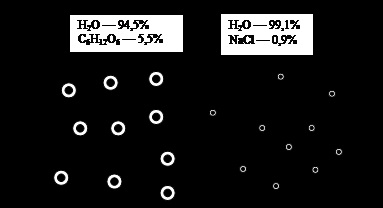
Fig. 5. Osmos. Explicații în text
Presiunea osmotică a sângelui, exprimată în termeni de concentrație molară este de 300 mmol / l, variind 285-310 mmol / l. Această valoare este extrem de important, iar corpul tinde să-l mențină în acest limite destul de înguste. Condițiile în care osmolaritatea este redus, vom numi gipoosmolyarnymi și sub care se ridică - hiperosmolara. Osmolarității, precum și un număr foarte mare de alți indicatori, ar trebui să fie monitorizat îndeaproape în supravegherea intensivă. Acesta poate fi măsurat direct Osmometru, și poate fi estimată prin calcul.
Principiul de funcționare al Osmometrul bazat pe următorul fapt fizic. Cantitatea de particule dizolvate identifică în mod unic nu numai presiunea osmotică, dar punctul de congelare și soluția la fierbere. Cu cât osmolalitatea, cel inferior punctului de congelare și punctul de fierbere deasupra soluției. Punct de îngheț osmometru măsoară fluid biologic fiind apos. Această temperatură va fi întotdeauna mai mică de 0 ° C Fiecare congelare unic corespunde o anumită concentrație molară a soluției, adică presiunea osmotică (indiferent de compoziția calitativă a soluției).
Despre estimat osmolaritate folosind o metodă de calcul, să ne uităm la secțiunea următoare.