• Na + / K + -ATPazei se referă la o ATPases de tip P, aproape de Ca2 + ATPase și H + -ATPaza
• Na + / K + -ATPazei Na + suporturi de gradient și K + prin membrana plasmatică
• Na + / K + -ATPaza a membranei plasmatice este un generator de sarcină electrică: aceasta efectuează trei celule de Na + ion pentru fiecare două K + ion, care se injectează în celulă
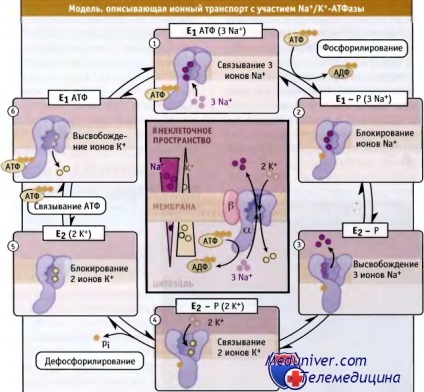
• Ciclu de Na + / K + -ATP-azică descrisă schema Post Albers, în conformitate cu care enzima se învârte între cele două conformații principale
În ceea ce privește mediul înconjurător, toate celulele sunt încărcate negativ. Acest lucru se datorează prezenței unui ușor exces de molecule încărcate pozitiv în spațiul extracelular, iar situația opusă în citosol. Pentru funcționarea normală a celulei pe părțile laterale ale membranei plasmatice trebuie să aibă un gradient electrochimic.
În acest sens, celula seamănă cu o baterie electrică cu taxe separate, care pot fi utilizate pentru a efectua lucrările. În celulele de mamifere, gradienții de concentrație de Na + și K + sunt două componente principale ale gradientului electrochimic transmembranar. In interiorul celulei, în comparație cu mediul extracelular, a menținut o concentrație mai mică de ioni de Na + și ionii de K + superior.
Formarea și menținerea unui gradient de electrochimice a ionilor de Na + și K + ioni in celule animale care să implice Na + / K + -ATPaza, care este o pompa de ioni folosind energia hidrolizei ATP pentru a transporta cationi. Cu ajutorul acestei enzime în celula este setat potențial negativ de repaus al membranei, cu care nivelul dorit al presiunii osmotice controlat, ceea ce previne lizează celula sau psihiatru, și care, de asemenea, oferă o Na + transport -dependente molecule secundare.
Na + / K + -ATPazei se referă la un grup de ATPases P-tip, care include, de asemenea, Ca2 + -ATPaza reticulului sarcoplasmic, care este acoperit într-un articol separat pe site-ul (recomandăm să folosiți formularul de pe pagina principală a site-ului).
Tip P ATPase sunt enzime. autofosforilare la care un rest de acid aspartic în procesul de transport ionic pentru a forma un produs intermediar fosforilat. In timpul autofosforilare grupului ATPases tip P y-fosfat din ATP este transferat la situsul activ al enzimei. Pentru fiecare moleculă de ATP hidrolizata schimb ionic trei Na + din citosol și doi ioni de K + din mediul extracelular. Na + / K + -ATPazei funcționează la o viteză de 100 de rotații pe 1 s.
Comparativ cu fluxul de ioni prin canalele de pori asemenea rată de transport pare scăzut. Transportul prin canale are loc la o rată de 107-108 ionilor în 1 s, m. E. Aproape de viteza de difuzie a ionilor în apă.
bond fosfat Energy este desemnată ca E1-P.
Cifra prezentată în centrul întregului ciclu al enzimei.
Se afișează gradiente de ioni de Na + și K + la partea staționară a membranei plasmatice a celulelor animale.
principalele etape ale ciclului enzimatic al transportului au fost caracterizate de ioni, care are loc cu participarea Na + / K + ATPaza. Acestea sunt reprezentate în diagrama de post-Albers. Inițial, acest sistem a fost sugerat pentru Na + / K + -ATP-ază și apoi utilizate pentru identificarea stărilor specifice ale unei molecule de ATPases tip P. Conform schemei Post-Albers, tip P ATPase poate lua două conformații diferite, care sunt etichetate ca 1 enzimă (E1) și enzima 2 (E2). În timp ce în aceste conformații, ei sunt capabili să comunice, ioni de captare și de transport. Aceste modificări conformaționale apar din cauza reacțiilor fosforilare-defosforilare:
• conformația ATP intracelular și ionii de Na + cu legare de afinitate ridicată la ATPase. Când această enzimă este transferată în E1ATF stare (3NA +) fosforilarea -dependente are loc reziduu de acid aspartic ATP și trei ioni de captare de Na + în conformație E1 - P (3NA +).
• alte rezultate schimbare de conformație în stare de E2-F, afinitate mai scăzută pentru ionii de sodiu, și să le lase în spațiul extracelular. Afinitatea enzimei pentru ionii K + este crescută.
• K + ATPaza Linking ioni, care sunt în spațiul extracelular care duce la defosforilare E2-P (2K +) și pentru a capta două dintre K + ioni cu o tranziție să indice E2 (2K +).
• Când ATP intracelular de legare modificări conformaționale și ioni K + sunt scindate. Atunci când are loc această condiție E1ATF și legarea intracelulare de sodiu conduc la conformații E1ATF (3NA +).
Analiza structurii primare a proteinelor permite să se presupună că toate ATPaza tip P au același mecanism structura și transportul spațial. Na + / K + -ATPaza este compus din două subunități, catalitică și la fel pentru toate ATPases de tip P și subunitate regulatoare, b, care este specific pentru fiecare ATPaza. Mai mică subunitate b are un domeniu transmembranar care stabilizează o subunitate a ATPase și determină orientarea în membrană. Celulele anumitor țesuturi activitate de Na + / K + -ATPazei, probabil guvernată de o altă subunitate de proteină y. subunitate catalitică, și conține situsuri pentru legarea ATP, iar ionul Na + și K +.
Această subunitate în formă izolată este capabilă de ioni de transport, așa cum se arată în experimentele de exprimare heterolog și studiile electrofiziologice.
structură subunitară și Na + / K + -ATPaza. construit conform cryoelectron microscop, seamănă cu structura Ca2 + ATPaza SERCA. La fel ca pompa SERCA, această subunitate este format din 10 helix transmembranare, de asemenea. Domeniul-P intracelular, situată între segmentele transmembranare 4 și 5, cuprinde un situs de fosforilare care posedă o structură comună pentru toate ATPases de tip P. Acest site este prezentat în caracteristica secvența de resturi Asp376 Asp-Lys-Thr-Gly-Thr-Leu-Thr. Legarea ATP și ionii de Na + induce modificări conformaționale semnificative în buclele de legătură N- și P-domenii. Aceste modificări conduc la convergența sitului de legare a ATP pe N-domeniu și situsul de fosforilare de pe F-domeniu.
Na + / K + -ATPaza este un generator de ioni pompa. În condiții fiziologice normale, energia liberă de hidroliza ATP (δGATF) cheltuită pentru transport din celule trei ioni de Na + în schimbul celor doi ioni de potasiu, în care ionii sunt transportate împotriva gradientului lor de concentrare. Astfel, celula pierde o sarcină pozitivă netă. Acest lucru contribuie la sarcina negativa a citosol, comparativ cu mediul extracelular. Ca rezultat, laturile diferenței de potențial de membrană celulară și gradientul osmotic ionic.
ATPases tip P sunt pompele de ioni folosind energia hidrolizei ATP pentru a menține gradientului ionic transmembranar. Pe măsură ce fiecare etapă a ciclului de fermentație este reversibilă, de tip P ATPase, în principiu, poate produce ATP, folosind energia potențialului transmembranar. Astfel, Na + / K + -ATPazei are o anumită capacitate de a opera în direcția opusă. În acest caz, ionii de Na + va intra în celulă și K + ionii să iasă, ceea ce ar conduce la faptul că fluxul de ioni este direcționată predominant în cușcă.
de transport comun de Na + ionii din celula si K + ionii in celula are loc până δGATF valoarea energetică electrochimică depășește gradientul de ioni corespunzător. Când energia necesară pentru transportul activ al ionilor de Na + și K + devine ioni egali δGATF curgere încetează. Această valoare reprezintă tratamentul potențial de funcționare Na + / K + -ATPaza, t. E. Valoarea potențialului de membrană, sub care enzima începe să lucreze în direcția opusă. Tratament Valoarea capacității de ordinul -180 mV, t. E., este o valoare mult mai negativă decât orice potențial de membrană celulară în condiții fiziologice. Prin urmare, este puțin probabil ca o celula poate intra în fluxul de ioni de Na +, având consecințe periculoase pentru ea.
Dar lucrurile se pot schimba cu o scadere a alimentarii cu sange. de exemplu infarct miocardic sau intoxicație, rezultând într-o lipsă de ATP sau pentru a crește prăvăliș gradientelor ionice. În final, acest lucru poate duce la o schimbare a direcției de transport a ionilor de Na + / K + -ATPaza si moartea celulelor.
Na + / K + -ATPaza este o tinta pentru multe toxine si medicamente. De exemplu, steroizii plante numite glicozide cardiace, cum ar fi ouabain și digitalice, sunt inhibitori specifici ai transportului ionic, implementat de Na + / K + -ATPaza. Printre inhibitorii specifici sunt, de asemenea, alte toxine, de exemplu, palytoxin unor corali marine și sanguinarină din plante. Spre deosebire de glicozide cardiace care inhibă fluxul de ioni prin Na + / K + -ATPazei, palytoxin și blocul sanguinarină ATPase în configurație deschisă.
Astfel, ionii sunt capabili de a fi transportate în direcția gradientilor lor de concentrare, ceea ce duce la o perturbare gradientelor electrochimice. glicozide cardiace se leagă reversibil la siturile de Na + / K + -ATPaza situate în afara celulei, în care a inhibat prin hidroliza ATP și transportul de ioni. atent controlată inhibarea + -ATPazei celulelor miocardice cu glicozide cardiace Na + / K, de exemplu digitalice, utilizate în tratamentul insuficienței cardiace. subpopulatii inhibarea parțială a Na + / K + -ATPazei glicozide cardiace crește ușor concentrația intracelulară a ionilor de Na +, ceea ce conduce la o creștere a concentrației de Ca2 + ioni, datorită transportului pe Na + / Ca2 + antiporter. Este cunoscut faptul că o mică creștere a concentrației de ioni de calciu intracelular crește contractilitatea mușchiului cardiac.
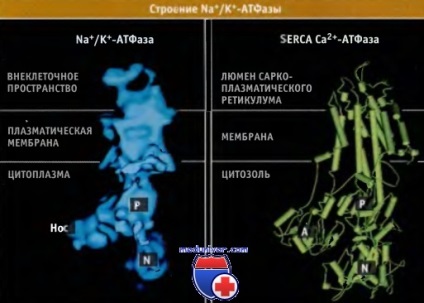
Structurile subunitare stabilite pe baza unui studiu de date microscop crio-electron.
Imagine SERCA conformație în structura cristalină a E2 pe baza datelor obținute de proteine Banca de Date fișier 1IW0.