Apă naturală conține, de obicei diferite săruri dizolvate și alte impurități, nedorite pentru utilizarea în industria apei și acasă. Majoritatea apei de ploaie este pură, dar conține unele cantități de diferite substanțe care Capteaza trec prin atmosfera.
Conceptul de „Duritatea apei“
Temporară (carbonat) rigiditate
Datorită prezenței de calciu și magneziu bicarbonați Ca (HCO3) 2 și Mg (HCO3) 2. Prezența acestor săruri în apă se explică prin dizolvarea carbonatului de calciu și magneziu, sub acțiunea apei naturale și dizolvat în acesta dioxid de carbon (dioxid de carbon), la contactul cu pietre (cum ar fi dolomita sau gips) conținând aceste săruri, de exemplu:


Duritatea carbonaților este numit temporar, deoarece aceste săruri descompuse pur și simplu prin apă clocotită.
duritate permanentă
Datorită prezenței în apă, în principal, sulfat de calciu și clorură de magneziu și CaSO4. MgSO4. CaCI2. MgCI2. Cel mai dificil este de a elimina CaSO4 sulfat. având o solubilitate mică.
Cantitatea de duritate temporară și permanentă va fi o duritate totală a apei:
În România duritatea apei caracterizate prin echivalenții numarul miligram de ioni de calciu și magneziu conținute într-un litru de apă. Un miligram echivalent (meq) rigiditatea corespunde unui conținut de 20,4 mg / l ionilor Ca2 + și 12,16 mg / l de ioni de Mg 2+ (Ca2 + 20,04 mg și 12,16 mg Mg 2+ - greutăţile miligram echivalente ale acestor cationi, adică a masei 1 10 -3 echivalenți ai acestor ioni).
Deoarece apa conține de obicei cationi ai ambelor metale simultan, duritatea apei este determinată prin următoarea expresie:
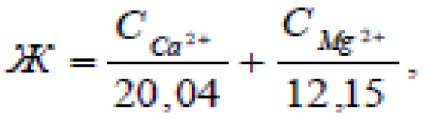
Tabelul 1 prezintă valorile durității apei România unele râuri din vara.
Tabelul 1. Valorile durității apei în timpul verii.
Raportul dintre carbonat și duritatea apei permanente este determinată de roci, spălate de sursa de apă.
Conceptul de „apă alcalină“
Alcalinitatea este determinată de cantitatea de apă conținută în apa de ioni hidroxil și anioni ai acizilor slabi - cărbune, organice și bicarbonat și ioni de carbonat. Astfel, valoarea alcalinității este un rigidități componente prin anioni.
Distinge bicarbonat, carbonat și alcalinitatea hidrat.
Sub alcalinitatea apelor naturale sau tratate înțeleg capacitatea unora dintre componentele lor de a se lega cantitatea echivalentă de acizi puternici. Alcalinitatea apei datorită prezenței anioni slab acide (carbonați, bicarbonați, silicați, borați, sulfiti, hidrosulfiți, sulfurile, hydrosulfides, anioni de acizi humici, fosfat). suma lor se numește alcalinitatea totală. Alcalinitatea totală a apei este definită în mod obișnuit numai anioni de acid carbonic (carbonat de alcalinitate). Anionii hidrolizat pentru a forma ioni de hidroxid:
CO3 2- + H2O <=> HCO3 - + OH-
HCO3 - + H2O <=> CO3 H2 + OH-
Astfel, alcalinitatea determinat cantitatea unui acid puternic necesar pentru neutralizarea 1 dm3 de apă. Alcalinitatea este determinată de majoritatea apelor naturale numai bicarbonați de calciu și magneziu, pH-ul apei nu depășește 8,3.
Eliminarea duritatii metoda de schimb ionic
În lume există modalități diferite de îndepărtare a durității (termic (fierbere) reactant, dializa, schimb de ioni). Alegerea metodei de dedurizare este în general determinată de calitatea apei la sursă, înmuierea adâncimea necesară și factorii tehnico-economici. În metoda noastră de companie comună de schimb de ioni (cationi), în cazul în care vom lua o mai aproape și sa oprit.
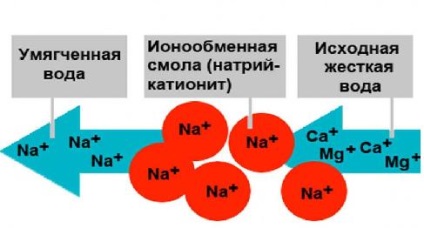
Metoda de schimb ionic se bazează pe schimbul de ioni de Ca 2+ si Mg 2+. conținut în apă, ionii de Na 2+ la H + sau prin trecerea apei prin rășini schimbătoare de ioni.
Rășina schimbătoare de cationi acționează ca un mediu de filtrare. Procesul de îndepărtare a durității apei prin purificare prin schimb de ioni folosind schimbător de cationi H poate fi descris prin următoarele ecuații:
În acest ultim caz, eliminarea duritatii însoțită de formarea de acid clorhidric puternic, care este coroziv pentru conducte și alte structuri metalice. Pentru a evita acest lucru, este mai bine să se utilizeze rășina schimbătoare de cationi de Na:

Aceste reacții arată că atunci când sodiu cationization carbonat de duritate a apei netratate trece în apă demineralizată în alcalinitate de sodiu. Cu alte cuvinte, atunci când valoarea alcalinității de sodiu-cationization nu se schimbă, care este principalul dezavantaj al acestui proces. Nemodificat asemenea compoziția anionice a apei: apa prezentă în anioni originali SO4 2-. Cl - și alte transformat în întregime în apă dedurizată. Aceasta se produce înlocuire doar mai mult sau mai puțin completă de cationi de calciu și magneziu, cationi de sodiu, în care rigiditatea apei kationirovannoy de sodiu este redus, iar reziduul uscat este oarecum crește.
apa moale satisface toate cerințele din aproape toate industriile la apă pentru răcire sau producerea de abur. apă moale supuse prelucrării minime pentru a crea fibre sintetice, materiale plastice, săpunuri prepararea soluțiilor, și multe altele. În apele moi au inhibat funcțiile vitale ale bacteriilor, care permite reducerea dozei de biocidă în apa care circulă.
Cu toate acestea, pe lângă proprietățile lor pozitive, apa moale ascunde o serie de dezavantaje serioase, dintre care unul este un corozivitate crescut la principalele materiale de conducte de apă. Acest lucru se datorează lipsei de ioni în duritatea apei. Pentru a evalua corozivitatea diverși indici au fost dezvoltate, inclusiv indicele Langelier și stabilitate Riznera.
index Langelier și indicele de stabilitate Riznera
om de știință Langelier SUA în 1936 pentru a evalua stabilitatea performanței soluției propuse, folosind o formulă bazată pe determinarea gradului de saturare a soluției de carbonat de calciu. Instabilitatea acestei soluții conduce la formarea de scară sau de coroziune.
Langelier indice formula: pH pH.
Pentru a determina indicele de Langelier nevoie de următoarele:
Cu ajutorul coeficienților auxiliari determinați și calculați valoarea intermediară - pH-uri.
Valorile Langelier Index:
indicele Langelier <0 образования накипи нет, раствор агрессивен (высокая коррозия);
index Langelier = 0 soluție este stabilă;
index Langelier> 0, există formarea zgurii, coroziunea nu se observă.
Mai târziu, în 1944. E Rizner act de faptul că stratul de scală de pe suprafața metalică poate preveni coroziunea. Pe baza coeficienților de calcul al indicelui Langelier Rizner oferit formula lui pentru calcularea stabilitatea soluției.

coroziunea electrochimică a conductelor

Scară în conductă
RSI = 2pHs - pH
2pHs - pH> 6 soluție este predispus la coroziune
2pHs - pH = 6 soluție este stabilă
2pHs - pH <6 раствор склонен к образованию накипи
Ca rezultat, ambele indicele poate fi redus la o evaluare agresivității tratament de clasificare prezentat în tabelul 2.