schimbare puternică a ratei de reacție la teoria schimbării explică temperatura de activare. Conform acestei teorii în interacțiunea chimie-cal introduce formule Molek numai active (particule) care au o energie. suficient pentru a osuschest-apariție a reacției. Particulele inactive pot fi active. daca le spui energia suplimentară necesară. - acest proces este numit de activare. Una dintre modalitățile de a activa - temperatura-chenie retrase. când temperatura crește numărul de specii active, este mult crescută. astfel SKO înălțime crește dramatic.
Energie. care trebuie să informeze moleculele (particule) ale reactanților. pentru a le transforma in activ. Se numește energia de activare.
Ea este determinată empiric. notat cu litera E și este de obicei exprimată în kJ / mol. Deci de exemplu. pentru un compus de hidrogen și iod (H2 + I 2 = H 2 I) Ea = 167,4 kJ / mol. și pentru dezintegrarea HI (2 H I = H 2 + I 2) Ea = 186,2 kJ / mol.
E o energie de activare depinde de natura reactanților și este caracteristică fiecărei reacții. Aceste idei sunt explicate-model:
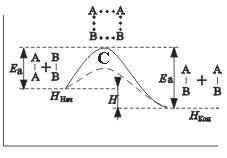
de exemplu, reacția în forma generală A 2 + B 2 2 = AB. axa ordonatei reprezintă potențialul sistemului-ing energetic, abscisa - reacția. original, stare de tranziție de stat → → stare finită-ing. Reactanții O formă 2 și B 2 o pro ucts AB reacție. acestea trebuie să depășească o barieră de energie C. La această energie de activare Ea este cheltuit. care crește valoarea sistemelor energetice noi. În cursul reacției dintre reactanți particule Obra-zuetsya instabilă grupare intermediară-wai. numita stare de tranziție, activate sau băi complex (la punctul C), din care descompunerea ulterioară duce la formarea produsului final AB. Mecanismul de reacție poate fi reprezentat de circuit
reactanti (starea inițială)
complex activat (o stare de tranziție)
produșii de reacție (un sistem finit)
În cazul în care descompunerea complexului activat este alocat mai multă energie. decât este necesar pentru activarea particulelor. reacția exo-termică. Un exemplu de reacție endotermă este procesul invers - formarea unei substanțe AB compușii A 2 și B 2 2 AB = A 2 + B 2 În acest caz, procesul se desfășoară, de asemenea, prin formarea unui activat complex A2 B 2. Cu toate acestea, cu atât mai mare de energie de activare. decât pentru procesul direct. Ed = Ea + # 8710; H (# 8710; H - căldura de reacție). Pentru reacții endoterme necesară alimentarea cu energie din exterior.
După cum se vede din figură

finite energii diferență la starea sistemului de noi (H con) și primar (H beg) este căldura de reacție.
Viteza de reacție depinde în mod direct de valorile energiei de activare. în cazul în care acesta este mic. apoi pentru un anumit timp de reacție va depăși bariera energetică a unui număr mare de particule și viteza de reacție va fi ridicată. dar, în cazul în care energia de activare este mare. reacția este lentă.
În interacțiunea energiei de activare a ionului este foarte mică și reacții ionice apar la o viteză foarte mare (aproape instantaneu).