cantitatea de căldură absorbită de corpul uman atunci când este încălzit 1 grad (1 ° C sau 1 K); să fie exact - raportul dintre numărul de căldură absorbită de către organism din cauza unei schimbări în infinitezimal său rata de riu, la această schimbare. Unități T.. greutate wa (r, kg) este numit. specific Volumul 1 mol în Insulele - mol (mol) T. Ed. T. servi J / (kg • K) J / (mol • K), J / (m 3 • K) și unitățile off-sistem. cal / (mol • K).
Cantitatea de căldură absorbită de organism atunci când se schimbă starea. Aceasta depinde nu numai de stările inițiale și finale (în special, asupra ratei lor de-riu), dar, de asemenea, pe cale de a-ochi a fost efectuat tranziția între ele. Prin urmare, metoda de încălzire depinde de corp si sunt de obicei distinse T. T. în post. Volumul (cv) și T la post. presiune (cp), dacă este menținut constant în mod corespunzător volumul sau presiunea acestuia în procesul de încălzire. Prin încălzirea la post. presiune de căldură se duce la producerea lucrărilor de extindere a corpului, iar unii - pentru a crește energia internă, în timp ce încălzirea la post. volumul toată căldura consumată pentru a crește ext. energie; în acest sens, cp este întotdeauna mai mare decât CV-ul. Pentru gaz (diluat, astfel încât acestea pot fi considerate ideale) diferența cf. T. mole-cv = R, unde R - Univers. constant de gaz. egal cu 8.314 x D / (mol • K), sau 1,986 cal / (mol • K). În lichide și TV. tel diferența dintre cp și CV-ul este relativ mic.
Din 1 și 2 au început termodinamicii care av = T (dS / dT) p și cv = T (dS / dt) v, m. E. T. proporții. derivat al entropia S pentru T D-paced sistem în condiții adecvate.
Teor. calcularea TA, în special, în funcție de corpul său rata de riu nu poate fi realizată printr-o pur termodinamic. metode și necesită aplicarea metodelor fizicii statistice (țintă de cunoștințe microstructura). T. Pentru gazele de calcul se reduce la calculul Wed. termică Dep energie mișcare. molecule. Această mișcare este formată din postupat. și vârtejul. mișcări ale moleculei în ansamblu și a oscilațiilor atomilor din moleculă. Potrivit clasice. Statisticile postupat pentru fiecare grad de libertate. și vârtejul. mișcări au un T. molar (cv) din cantitatea de gaz egal cu R / 2, și fiecare kolebat. gradul de libertate - R; este de obicei numit. legea echipartiție. B-ca gaz monoatomic are doar trei postupat. grade de libertate, respectiv, ar trebui să fie T. cv 3R / 2 (t hn / k, unde n. - frecvență de oscilație.
Intervalele dintre vârtejul. nivelele de energie ale unei molecule diatomice (împărțit la k) reprezintă doar câteva. K și numai pentru astfel de molecule de lumină ca molecula de hidrogen, ajunge la sute de K. Prin urmare, atunci când rata normala rah-vârtejul. T. parte dihidroalcool (și polihidroxilic) de gaz echipartiție se supune legii. Intervalele dintre kolebat. nivelurile de energie ajunge la mai multe. Prin miile, și, prin urmare, la o lege normală ritm-Rah echipartiție nu este aplicabilă kolebat. Calcularea T. T. statisticilor cuantice conduce la rezultatul că kolebat. T. scade rapid cu scăderea tempo-riu, care tinde spre zero. Aceasta explică faptul că, chiar și la ritmul normal de-rah kolebat. porțiunea T. este practic absentă și T. mol gaz diatomic este 5R / 2 în loc de 7R / 2.
La suficient de scăzută rata pax T., în general, trebuie să fie calculată utilizând statisticile cuantice. După cum se dovedește, T. scade odată cu scăderea ratei-riu la zero la T ®0 în acord cu m. N. Principiul Nernst (a treia lege a termodinamicii).
În televizor. (Cristalin). Organele mișcării termice a atomilor este o anumite mici oscilații lângă poziții de echilibru (nodurile cristae.) Grile. Fiecare atom are m. O. trei kolebat. grade de libertate, și, în conformitate cu legea echipartiției, Mole T. TV. Corpul (. T. cristae zăbrele) trebuie să fie egal 3nR, unde n - numărul de atomi în moleculă. În realitate, însă, această valoare - limita doar la a-rom caută T. TV. corp la ritmul alert-Rah. El a ajuns la ritmul obișnuit-rah în multe altele. elemente metalice inclusiv (n = 1, t n Dulong și Petit lege ..) y anumitor compuși simpli (NaCl, MnS (n = 2), PbCI2 (n = 3), etc.) ...; în compuși complecși, de fapt, nu se atinge această limită, adică. k. înainte de a se produce topirea în insulele sau descompunerea acesteia.
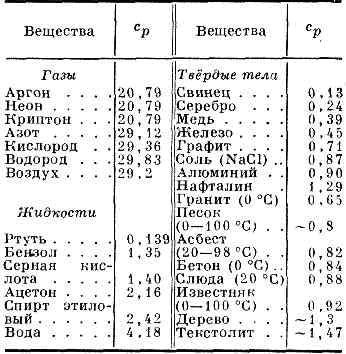
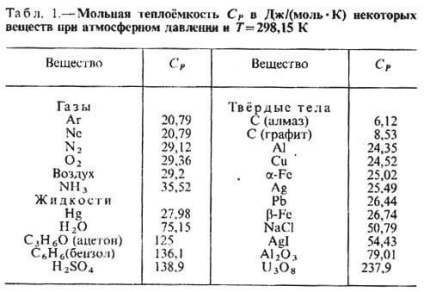
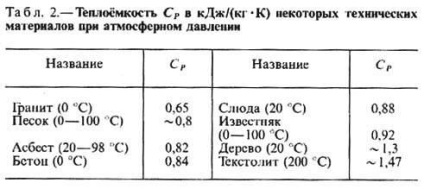
cp căldura specifică a anumitor gaze (în J / (mol • K), lichide sau solide (în kJ / (kg • K) ATM AT. Presiunea și la t = 25 ° C
La nivelul temp-rah, componenta zăbrele T. TV. corp se transformă raportul. abs cub. ritmul-riu (capacitate termică Debye a legii). Criteriul de a distinge între înaltă și joasă temperatură-riu, yavl. comparația cu caracteristica fiecărui parametru în Insulele - m.
- Numărul de căldură; absorbită de corpul uman atunci când este încălzit 1 grad (1 ° C sau 1 K); să fie exact - raportul dintre numărul de căldură absorbită de către organism din cauza unei schimbări în infinitezimal său rata de riu, la această schimbare. T. unități de masă de materie numite. Volum specific 1 mol substanță molară (mol) T. T. Unitățile sunt J / (kg · K) DzhDmol · K), J / (m 3 · K) și unitate în afara sistemului de cal / (mol · K).
Cantitatea de căldură absorbită de organism atunci când modificările de stat nu depinde numai de stările inițiale și finale (în special, asupra ratei lor de-riu), dar, de asemenea, pe cale de a-ochi a fost efectuat tranziția între ele. Prin urmare, metoda de încălzire depinde de corp si sunt de obicei distinse T. T. în post. volum (CV) și T la post. presiune (P P), în cazul în care procesul de încălzire menținut la volum constant, respectiv, sau corpul de presiune. Prin încălzirea la post. presiune de căldură se duce la producerea lucrărilor de extindere a corpului, iar unii - pentru a crește energia internă, în timp ce încălzirea la post. volumul toată căldura consumată pentru a crește ext. energie; în legătură cu CP este întotdeauna mai mare decât CV-ul. Pentru gaz (diluat, astfel încât acestea pot fi considerate ideale) TS molar diferența P - CV = R, în care R - este gazul universal constant egal cu 8.314 J / (K · dmol) sau 1,986 kalDmol · K). În lichide și solide diferența între P C și CV relativ mici. T. Deoarece P anumitor substanțe și materiale enumerate în tabelul. 1 și 2.
Din legile 1 si 2 ale termodinamicii care m. Proporțiilor E. T.. derivat al entropia S pentru T D-paced sistem în condiții adecvate.
Teoretic. calcularea TA, în special, în funcție de corpul său rata de riu nu poate fi realizată printr-o pur termodinamic. metode și necesită aplicarea metodelor fizicii statistice (cunoașterea substanței microstructură). T. Pentru gazele de calcul se reduce la calculul Wed. termică Dep energie mișcare. molecule. Această mișcare este formată din postupat. și vârtejul. mișcări ale moleculei în ansamblu și a oscilațiilor atomilor din moleculă. Potrivit clasice. Statisticile postupat pentru fiecare grad de libertate. și vârtejul. mișcări au un T. molar (C V) a cantității de gaz egal cu R / 2, și fiecare kolebat. gradul de libertate - R; este de obicei numit. ravnoraspredeleniyazakonom. Particule de gaz monoatomic are doar trei postupat. grade de libertate, respectiv, acesta T. V C trebuie să fie 3R / 2 [m. K) sau
3 cal / (mol. K)], este în bună concordanță cu experimentul. molecula de gaz diatomica are trei postupat. două vârtejul. și unul kolebat. grade de libertate, și legea echipartiție conduce la CV valoarea = 7R / 2. Experiența arată că T. mol de gaz diatomic (într-un ritm-PAX normal) este 5R / 2. Această discrepanță între teorie și experiment datorită faptului că calculul T. trebuie să ia în considerare efectele cuantice, adică. e. utilizarea statisticilor cuantice. Conform mecanicii cuantice, orice sistem de particule care efectuează oscilații sau rotație (în t. H. Molecula de gaz) poate fi definit numai. Valorile energetice discrete. În cazul în care energia de mișcare termică în sistem este insuficient pentru a excita oscilații determinate. frecvență, aceste fluctuații nu contribuie la sistemul T. (care corespunde gradului de libertate este „înghețat“ - aceasta nu se aplică legea echipartiției). Temp T-pa, realizând în același timp o lege roi echipartiție se aplică învârtească. sau kolebat. gradul de libertate este determinată de-mecanică cuantică. ceea ce în cazul în care v - fluctuațiile cursului.
Intervalele dintre vârtejul. nivelele de energie ale unei molecule diatomice (împărțit la k) reprezintă doar câteva. K și numai pentru astfel de molecule de lumină ca molecula de hidrogen, ajunge la sute de K. Prin urmare, atunci când rata normala rah-vârtejul. T. parte dihidroalcool (și polihidroxilic) de gaz echipartiție se supune legii. Intervalele dintre kolebat. nivelurile de energie ajunge la mai multe. Prin miile, și, prin urmare, la o lege normală echipartiție-ritm pax nu se aplică kolebat. Calcularea T. T. statisticilor cuantice conduce la rezultatul că kolebat. T. scade rapid cu scăderea tempo-riu, care tinde spre zero. Aceasta explică faptul că, chiar și la normal ritm pax kolebat. porțiunea T. este practic absentă și T. mol gaz diatomic este 5R / 2. în loc 7R / 2.
La suficient de scăzută rata pax T., în general, trebuie să fie calculată utilizând statisticile cuantice. Când T> 0 T scade în conformitate cu m. N. Principiul Nernst (a treia lege a termodinamicii)
Solidul (cristalin). Organele mișcării termice a atomilor este mici oscilații aproape determinate. pozițiile de echilibru (componente cristaline. grilajului). Fiecare atom are m. O. trei kolebat. grade de libertate, și, conform legii echipartiției, T. molar solid (T. cristalin. grilelor) trebuie să fie egală cu W nR. n cazul în care numărul de atomi în moleculă. În realitate, însă, această valoare - singura limita la a-rom, dorește corp solid T. cu mare ritm-PAX. El a ajuns la ritmul obișnuit-PAX, în multe altele. .... Elementele din t h la metalul (n = 1, 3 (Debye capacitatea calorică a legii) Criteriul de a distinge între rata de ry înaltă și joasă este o comparație cu caracteristica fiecăreia dintre substanțele - așa-numita caracteristică .. sau temperatură Debye QD Această valoare este determinată de spectrul vibrațiilor atomice în organism și, astfel, depinde în mod considerabil cristalină. structura (a se vedea. vibrațiile cristalului cu zăbrele). ordinea valoare Kq Tipic qd câteva. sute K, dar poate fi la fel de mare (de ex. în diamant) și mii de K,
In metale este determinat. T. da contribuție la electronilor de conducție și, de asemenea (a se vedea. Capacitatea de căldură e). Această porțiune T poate fi calculată cu ajutorul Fermi - Dirac statistici sunt supuse unui roi electroni. E T. proporție din metal. T. Este, totuși, valoare relativ mică, contribuția la T. de metal devine semnificativă numai atunci când rată pax, aproape absolut, zero (aproximativ mai multe. K), atunci când, T. zăbrele (
T 3) devine neglijabilă. In forma cristalina. organisme cu un aranjament ordonat de magnet de spin. momente ale atomilor (materiale feromagnetice și antiferomagnetice), există completeze. Magnus, componenta T. Când tempo-re în tranziția de fază paramagnetic. de stat (la punctul Curie sau punctul Neel, respectiv), această componentă T. se confruntă cu o creștere bruscă - există o „graba“ T, care este o trăsătură caracteristică a tranzițiilor de fază de două fel.
Lit. Landau L. D. Lifshits E. M., Fizică statistică. 3rd ed. Partea 1, M. 1976 .; Tabele de mărimi fizice. Handbook, ed. I. K. Kikoina, M. 1976. E. Lifshitz.