Reducator. Insulele din donator de electroni în okislit.-restaurare. p-tiile. Rel. restaurare. capacitatea de două sau mai multe în program de completare determinată prin compararea variația energiei Gibbs pentru p-tiile ale acestora într-una în același comburant. iar în cazul p-tiile cu un simplu-la - (. oxizi, halogenurile și altele asemenea) energia Gibbs a formării produșilor de oxidare în simplu-VA. Mai mult sau ABS. valoare, agentul reducător mai activ este prezent în cantitate. astfel încât, în condiții normale, în p-tiile mM'Fn nM + -> nMFm + mM'kaltsy - fluoruri reducătorul metalice mai active (CaF2 legat de un atom de fluor - .. 584,2 kJ / mol) decât Mg (-535 5 kJ / mol) și A1 (-477.1 kJ / mol), dar mai puțin activ decât Li (pentru LiF - 588,0 kJ / mol). În cazul electrochimic. p-tiile pentru comparare de restaurare. capacitatea de a utiliza -in un electrod standard de potențiale ° E. Cu cât este mai absolută. E ° valoarea de jumătate de reacție care implică recuperarea unui Insulele, cu atât mai puternică va prelua comunicare-vă în această cantitate are.
Să aparțină unui puternic agent reducător și alcalin schel.-land. metale. Al, Si, C, H2 și un număr de al., Într-un procedeu simplu, hidruri metalice si comp. conținând nemetalelor cu otritsat. stări de oxidare (și altele.). Foarte puternic pentru a recupera. au capacitatea de a p-riu conținând Svob. sau electroni solvatată. de ex. amoniu p-ry și alcaline schel.-land. metale (vezi. amoniac) și hidrogen atomic.
Există în insule, la secară în aceeași okislit.-restore. p-TION sunt ambii agenți de reducere și agenți de oxidare. Într-o astfel de moleculă, sunt conținute în atomi. și conectarea electroni donează. de ex.
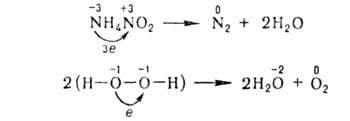
===
App. Literatura pentru articolul „agent de reducere.“ Apoi b ML Mecanisme de reacții anorganice. per. din limba engleză. M. 1975, p. 181-82. E. G. Rakov. B. D. Stepin.
