Chimia proteinelor. Caracteristicile generale ale proteinelor și aminoacizi.
Caracteristici generale și proteine cu valoare biologică.
Proteinele sunt cele mai importante și complexe de compuși organici, care fac parte din organismele vii. Nu numai că orice fel de viață, dar, de asemenea, la fiecare organ, fiecare tip de celulă are propriul set specific de proteine.
Ca o proporție pe care o ocupă primul loc printre toate cuprinse într-un macromolecule celulelor vii. Astfel, proteinele din corpul uman are la bază 40-50% din greutatea uscată.
Fiecare individ este diferit de cele ale propriei specii proprii set de proteine (individualitate biochimice). Această personalitate este susținută de toate organismele vii. La introducerea proteinelor străine în organism format substanțele protectoare (anticorpi) și altele care distrug proteinele. Cu toate acestea, există o similitudine între anumite proteine de același tip, care permite schimbul de proteine (de exemplu, transfuzie de sânge).
Proteine - un nivel ridicat de compuși cu greutate moleculară construite din aminoacizi. Crearea cei 20 de aminoacizi ai proteinelor implicate. Ele comunică unul cu celălalt în lanțuri lungi, care stau la baza moleculei de proteină cu greutate moleculară mare.
Proteinele indeplinesc functii importante in organism:
Catalizator Ø - aproape toate reacțiile chimice ce au loc într-o celulă animală, catalizată de substanțe specifice numite enzime. Punct de vedere chimic, toate enzimele sunt proteine.
Structural Ø - 1/5 proteine constituie porțiuni, sau 20% din greutatea corporală. Colagenul - proteina structurală a țesutului conjunctiv.
Ø Energie - dezintegrarea completă a 1 g de proteină eliberată 17,15 kJ (4,1 kcal) de energie, ceea ce indică capacitatea acestora de a participa la alimentarea cu energie a organismului. Cu toate acestea, utilizarea proteinelor în acest scop, are loc numai atunci când există o lipsă de surse de energie de bază - carbohidrați și grăsimi.
Transport Ø - anumite proteine de grupa de sange are capacitatea de a interacționa cu o varietate de compuși și a le transfera. Deci, transportate în apă corp substanțe insolubile (ioni, metale, gaze) sau produse toxice (bilirubina, acizi grași, etc.). Un exemplu de proteine de transport poate servi hemoglobina (transporta oxigen si dioxid de carbon), transferină (proteină purtătoare de fier), lipoproteine - proteine complexe care transportă lipide.
Protecție Ø - în timpul evoluției pentru a dezvolta un mecanism de recunoaștere și de legare a moleculelor „străine“ prin proteine specifice (anticorpi).
Ø reglementare - proteine specifice sunt hormoni implicați în reglarea diferitelor procese care au loc în organism. Proteinele implicate în reglarea constantelor sanguine importante asigură o presiune oncotică a sângelui; parte a sistemelor tampon, afectează echilibrul acido-bazic al sângelui.
Ø proteine de participare la procesele ereditare, adică stocarea și transmiterea informației genetice. Această funcție este realizată proteine complexe - nucleoproteine.
Ø Contracția - o caracteristică importantă de viață este de mobilitate. Ea se bazează pe funcția contractila a proteinelor.
Ø hemostatice funcționale - proteine implicate în formarea unui cheag de sânge și pentru a preveni sângerarea.
Compoziția chimică a proteinelor.
Proteinele sunt compuși complecși, polimeri care constau din compuși simpli, moleculară scăzută - monomeri.
Componentele de pornire ale proteinelor sunt aminoacizi care definesc proprietățile fizico-chimice și biologice ale proteinelor.
Aminoacizii - amino derivați ai acestei clase de acizi carboxilici.
Aminoacizii organismelor vii pot fi împărțite în proteinogenici (codificate prin codul genetic) și nonproteinogenic (care nu este codificat prin codul genetic). Proteinogenici aminoacizi 20; 19 dintre ele sunt α-aminoacizi. înseamnă că un atom de carbon α-atom de hidrogen substituit cu grupare amino (NH2). Formula generală a acestor aminoacizi este următoarea:
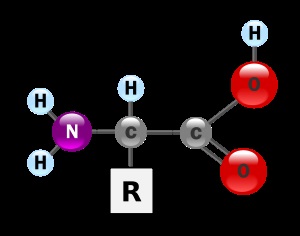
Numai aminoacid - prolină nu corespunde cu această formulă generală. Ea aparține imino.
α-amino atom de carbon asimetric este acidul (excepție este compusul amino cu acid acetic acru tine - glicină). Fiecare aminoacid are cel puțin două antipod optic activ. Natura a ales să Nia Crearea proteine L-formă, astfel încât proteinele naturale sunt construite din L-acizi amino -a.
Pentru etichetarea aminoacizilor sunt proprietățile fizico-chimice ale radicalilor lor. Există abordări diferite față de această clasificare.
Cele mai multe dintre aminoacizi - este compuși alifatici, doi aminoacizi aparțin seriei aromatice și doi - la heterociclic.
Aminoacizii pot fi clasificate în funcție de proprietățile lor pe bază, neutre și acide.
Acestea diferă în numărul de grupări amino și carboxil din moleculă. Neutral conțin un amino și o grupare carboxi. Acid au două acid carboxilic și o grupă amino este de bază - două grupări amino și una clorhidric carboxil.
Profitând de astfel de proprietăți ale aminoacizilor, ca polaritatea. ele se pot diviza într-un grup de nepolari (hidrofobi) aminoacizi (alanina, valina, leucina, izoleucina, metionina, aproximativ ling, fenilalanină, triptofan), grupare polară (hidrofilă GUVERNAMENTAL) aminoacizii neîncărcate (glicina, serina, treonina, cisteina, tirozina , asparagină, glutamină) otritsatelnozaryazhennyh grup (acid) aminoacizi (acid aspartic și glutamină nou) și un grup de încărcați pozitiv () aminoacizi bazici (arginină și lizină).

În funcție de capacitatea unei persoane de a le sintetiza din precursori
Esențial: triptofan, fenilalanină, lizină, treonină, metionină, leucină, izoleucină, valină.
Interschimbabili: tirozină, cisteină, histidină, arginină, glicină, alanină, serină, glutamat, glutamină, aspartat, asparagina, prolina.
Unii dintre aminoacizii esențiali sunt sintetizați în organism în cantități insuficiente, și trebuie să provină din alimente.
Sobstvennoalifaticheskimi 5 aminoacizi pot fi numite.
Glicina (Gly), sau glicină (acid aminoacetic) yavlya- etsya amino singur optic inactiv datorită lipsei atomului de carbon asimetric. Glicina este implicat în sinteza proteinelor și formarea de bilă a acizilor nucleici (atomii săi fac parte din compoziția nucleotidică a hemului și importante glutation tripeptide), și este de asemenea necesară pentru neutralizarea produselor toxice în ficat.
Alanina (Ala) (acid aminopropionic) adesea corpul Transmite glucoza sinteza.
Valină (Val) - acid aminoisovaleric, leucină (Leu) - Acid aminoizokapronovaya, izoleucină (lle) - a-amino-β-etil-β-metilpropionic, exprimarea conjugat care posedă proprietăți hidrofobe. Acestea joacă un rol important în formarea structurii spațiale a moleculei alb-kovoy. implicat activ în metabolismul.
Serină (Ser) - α-amino-β-hidro ksipropionovaya reonin acidă și T (Thr) - acid hidroxibutiric a-amino-β- - joacă un rol important în procesele de modificare covalentă a structurii proteinei. Grupul lor hidroxil interacționează cu ușurință cu acidul fosforic, care este necesară pentru a schimba activitatea funcțională a proteinei. Serina este inclus cu diferite enzime, proteine din lapte de bază - cazeină se găsesc în compoziția lipoproteinelor și alte proteine. Treonina este implicat în biosinteza proteinelor.
Cisteină (Cys) - a-ami but-β-tiopropionic acid datorită activ - SH - grup suferă ușor de oxidare-vosstanovitelnyereaktsii. protejarea celulelor împotriva acțiunilor oxidanti implicați în formarea de punți disulfidice care stabilizează structura proteinelor. Două molecule de cisteină sunt oxidați pentru a forma cistina. Aceasta formează o legătură disulfurică.
Metionina (Met) - a-amino-β-tiometilmaslyanaya de acid - acționează ca mobil donor de grup metil. necesar pentru sinteza compușilor biologic activi: colina, nucleotide, etc ..
Acid glutamic (Glu) - a-aminoglutaric și acid A sparaginovaya (Asp) - a-aminoyantarnaya acidului - cele mai comune aminoacizi ai proteinelor de organisme animale. Cu pre suplimentar-o grupare carboxil în radicalul, acești aminoacizi contribuie la ion de interacțiune. da taxa a moleculei de proteină. Ele sunt implicate în biosinteza proteinelor, formarea de compuși importanți (neurotransmitatori inhibitoare ale sistemului nervos, alți aminoacizi), metabolismul energetic. Acești aminoacizi pot forma amide.
- Amidele aminoacizilor dicarboxilici. glutamină (Gly) ISS-paragin (Asn) - o funcție importantă în eliminarea și transportul amoniacului într-un organism.
Tsiklicheskieaminokisloty au în radicalul lor de inel aromatic sau heterociclic.
Fenilalanina (Ceas) Acid -α-amino-β-fenilpropionic și tirozină (Tyr) - a-amino-β-paraoksifenilpropionovaya acidului - acești doi aminoacizi formează o pereche interconectată îndeplinește funcții importante în organism, de exemplu, participarea la sinteza unui număr de biologic substanțe active (renalin ad-, tiroxină). Fenilalanina este sursa principală de sinteză a tirozinei, un precursor al unui număr de substanțe biologice importante: hormoni (tiroxina adrenalină), unii pigmenți.
Triptofan (trei) - a-amino-β-indolilpropionovaya lot pis utilizat pentru sinteza de vitamina PP, serotonină-Mons epifizei fierbinte.
Histidină (GIS) - α-amino-β-imidazolilpropionovaya pis lot pot fi utilizate în formarea histaminei-lating regu permeabilității capilare și care prezintă efectul în alergie.
Lizina (Lys) - și A rginin acidului diaminokapronovaya (Ap r) - a-ami acidului but-β-guanidinvalerianovaya - au grupa amino complement țional care conferă proprietățile de bază ale proteinelor care conțin multe astfel de aminokis-lot. Lizina este necesar pentru sinteza proteinelor, inclusiv histone care alcătuiesc nucleoproteine; găsit în structura unor enzime. Educația face parte dintr-un metabolit al arginin-agenție cale amoniac neutralizare (sinteza urina defect).
Imino - prolina (Pro) este diferit de ceilalți aminoacizi din punct de vedere structural. O atenție deosebită este acordată acestui aminoacid în structura colagenului în care prolina în timpul sintezei de colagen poate fi convertit în hidroxiprolina.