Obiectiv: Pentru a determina concentrația metodei de titrare acidă.
Reactivi: apă distilată, soluții de HCl acid clorhidric (sau HNO3) și hidroxid de sodiu NaOH (sau KOH) concentrație 0,1mol / l soluție de fenolftaleină (soluție de alcool) sau portocaliu metil.
Echipamente: flacoane conice 50-100 ml capacitate pipetă de 10 ml, 25 ml biureta, o capacitate de 50-100 ml mensure, picurătoare pentru indicatori, tije de sticlă, hârtie de filtru.
Metodele de lucru
Pentru funcționare trebuie să aibă o soluție de hidroxid de sodiu de concentrație de NaOH de 0,1 mol / l.
La fel ca în 4.2. Se prepară biurete umplute cu o soluție alcalină. Dial pipeta 10 ml de soluție de acid și se toarnă într-un balon conic de 100 ml; pentru a intra în 2-3 picături de indicator fenolftaleină. Balonul a fost pus pe hârtie albă de biuretă.
Mai departe spre titrare: soluție alcalină de biureta Păstrați mici porțiuni, aproximativ 0,2 ml, într-o soluție acidă, care a fost agitat continuu.
Zona de soluție, care se încadrează alcaline, vopsite în culoarea roz dispare sub agitare. Când soluția roz va dispărea încet începe să scadă soluția de acid 0,1 ml, și astfel să continue până când soluția din balonul dintr-o singură picătură nu va slabi, dar soluția de colorare suficient de stabile. În această titrare se termină.
Se determină volumul soluției diviziuni biuretă de alcalii cheltuite pentru neutralizarea acidului.
Titrarea a fost repetat de încă două ori, de fiecare dată începând cu diviziunea biuretă zero.
Suma luată de valori de volum obținute acide și alcaline sunt înregistrate în tabelul. 4.3.
experiment și de calcul rezultate
Întrebări pentru auto-preparare și control
1. Ce este titrare? Cum este această operație?
2. Ceea ce se numește soluția standard?
3. Care este punctul de echivalență și modul în care este fixat?
4. De ce este punctul de echivalență, se observă o schimbare bruscă în culoarea indicatorului?
5. Ce indicatori sunt utilizați în titrarea soluției?
6. Care este zona de tranziție a indicatorului?
7. În ce fel de mediu își schimbă culoarea metilorange și fenolftaleină?
8. În ce raport volumetric de soluții reactante sunt aceleași și diferite concentrația molară?
Tema 5. Cinetică chimică și echilibrul de definiții de bază și termeni
Reacțiile chimice continua la rate diferite. De exemplu, reacția de neutralizare are loc aproape instantaneu, în timp ce reacția hidrogenului cu oxigenul la temperatura camerei și în absența catalizatorului are loc foarte lent. Doctrina ratelor reacțiilor chimice se numește cinetica chimică.
Viteza de reacție este determinată de modificarea concentrației pe unitatea de timp. Datorită faptului că concentrația de materii prime se schimbă continuu, viteza de reacție este exprimată prin derivata concentrației timpului
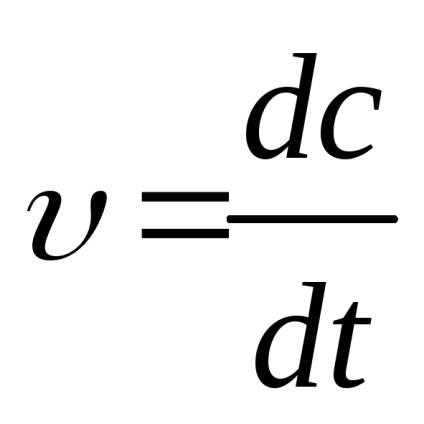
unitate astfel încât viteza de reacție este mol / s.
reacțiile moleculare este numărul de molecule (particule) implicate în caz elementar reacției chimice. Pe această bază toate reacțiile sunt împărțite:
1) pe monomolecular (o reacție de descompunere, o izomerizare);
2) bimolecuă (reacții de saponificare, esterificarea, etc.) .;
3) trimolecular (saponificarea catalitică a esterilor și altele.).
Probabilitatea unei coliziuni simultane a mai multor molecule de un anumit tip este neglijabil; astfel încât reacțiile trei molecule sunt rare.
In general, reacția chimică poate fi scrisă astfel:
Pentru o astfel de reacție chimică matematică schemă notație exprimată de relația
Pentru această reacție, în conformitate cu Intenția de bază Kinetics chimice
unde CA și CB - concentrația reactanților, mol / l; a și b - Coeficienți stoichiometrice substanțele A și B; k - constanta vitezei unei reacții chimice.
Așa cum este prezentat în ecuația (5.1), k = υ, dacă CA = CB = 1 mol / l. Prin urmare, constanta de viteză este numeric egală cu viteza de reacție chimică a reactanților, la concentrații egale cu 1 mol / l. Valorile numerice ale coeficienților a și b în ecuația de ordinul reacției este determinată de substanța și lor sumă - procedura generală pentru reacție.
Ordinea de reacție poate lua orice pozitiv (inclusiv 0 și fracționare numerele) de valoare. Ea determină ecuația cinetică de tip permite calcularea vitezei de reacție chimică constantă pentru reacția
unde C0 - concentrația inițială a substanței A, mol / l; Ct - concentrația de substanță A mol curent / l; t - timpul scurs de la începutul reacției până la t. a.
Ordinea de reacție este determinată din datele experimentale ale schimbării concentrației în timp a reactanților.
Pentru reacțiile complexe sunt reversibile, în serie, în paralel, și o altă reacție.
Reacțiile reversibile sunt cele în care, odată cu progresul formării produsului de reacție inainte procedeaza materialele de reacție inversă de sinteză de pornire:
Chemat reacții paralele, în care materia primă de moduri diferite, cu diferite viteze și viteză constantă de formare a două sau mai multe produsului:
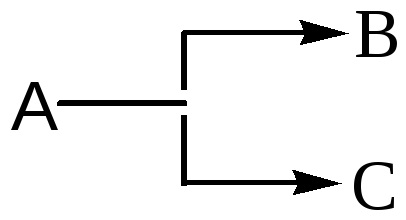
Secvență este denumită reacție însoțită de formarea și transformarea intermediarilor:
Reacțiile reversibile sunt caracterizate prin constanta de echilibru K. se determină din relația
unde k1 și k2 - viteză constantă înainte și reacții inverse.
Constanta de echilibru poate fi orice valoare pozitivă. Aceasta depinde de mai mulți factori (temperatură, presiune, concentrația reactanților, etc.) și este determinată de principiul echilibrului dinamic Le Chatelier lui - Brown. Conform acestui principiu, la orice schimbare a parametrului extern, care determină starea sistemului, echilibrul sistemului este deplasat în lateral, efectul de slăbire a impactului acestui parametru. Astfel, în cazul în care reacția are loc cu eliberarea de căldură, creșterea temperaturii deplasează echilibrul spre formarea materiilor prime și răcirea - în direcția formării produșilor de reacție.
În cazul în care reacția are loc cu o creștere a cantității de substanță produselor gazoase, reacția mai completă în direcția înainte, va contribui la scăderea presiunii și invers - creșterea.
In cele mai multe cazuri, rata și viteza de reacție constantă depinde de temperatura. De obicei, la temperaturi mai ridicate crește viteza. Această relație este exprimată aproximativ de empiric regula van't Hoff, potrivit căreia rata majoritatea reacțiilor chimice crește cu temperatură la fiecare 10 de grade (în temperatura la 100? C) crește de două până la patru ori. Matematic, acest lucru este scris după cum urmează:
și unde kT kT + 10 - viteze de reacție constante la temperaturi T și T 10; - temperatura coeficientului vitezei de reacție ( = 2 - 4). Folosind această regulă, putem estima schimbarea vitezei de reacție într-un interval de temperatură mică (0-100 C?):
Mai precis, dependența vitezei de reacție la temperatură este determinată de ecuația Arrhenius:
în care R - este constanta universală a gazelor, J (mol ∙ K); R = 8,314; E - energia de activare, J / mol.
Energia de activare a unei reacții chimice se numește energia minimă, care trebuie să aibă molecule sensibile pentru a depăși forțele de repulsie reciprocă a coliziunii.